
题目列表(包括答案和解析)
51.(10分)已知可逆反应CO + H2O(g)  CO2 + H2,达到平衡时,K =
CO2 + H2,达到平衡时,K =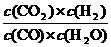 ,K是常数,只与温度有关,与浓度无关。
,K是常数,只与温度有关,与浓度无关。
(1)830K时,若起始时:c (CO) = 2 mol/L,c (H2O) = 3 mol/L,平衡时CO的转化率为60%,水蒸气的转化率为______________;K值为______________。
(2)830K,若只将起始时c (H2O)改为6 mol/L,则水蒸气的转化率为____________。
(3)若830K时,起始浓度c (CO) = a mol/L,c (H2O) = b mol/L,H2的平衡浓度c (H2) = c mol/L,
①a、b、c之间的关系式是____________________________________;
 ②当a = b时,a = __________c。
②当a = b时,a = __________c。
50.(10分)
Ⅰ.已知pH=2的高碘酸(H5IO6)溶液与pH=12的NaOH溶液等体积混合,所得溶液呈酸性;0.01 mol·L-1的HIO3或HMnO4溶液与pH=12的Ba(OH)2溶液等体积混合所得溶液均呈中性。
(1)H5IO6是 (填“强电解质”或“弱电解质”)。
(2)已知H5IO6和MnSO4在溶液中反应生成高锰酸、碘酸和硫酸,此反应中氧化剂
是 (填化学式)。
Ⅱ.已知某溶液中只存在OH-、H+、NH4+、Cl-四种离子,某同学推测其离子浓度大小顺序有如下四种关系:
①c(Cl-)>c(NH4+)>c(H+)>c(OH-) ②c(Cl-)>c(NH4+)>c(OH-)>c(H+)
③c(NH4+)>c(Cl-)>c(OH-)>c(H+) ④c(Cl-)>c(H+)>c(NH4+)>c(OH-)
填写下列空白:
(1)若溶液中只溶解了一种溶质,则该溶质是 ,上述四种离子浓度的大小顺序为 (填序号)。
(2)若上述关系中③是正确的,则溶液中的溶质为 ;若上述关系中④是正确的,则溶液中的溶质为 。
(3)若该溶液是由体积相等的稀盐酸和氨水混合而成,且恰好呈中性,则混合前c(HCl)
c(NH3·H2O)(填“大于”、“小于”或“等于”,下同),混合前酸中c(H+)和碱中c(OH-)的关系c(H+) c(OH-)。
49.(8分)
Ⅰ.下列有关仪器的使用,能实现的是_______________(填序号)
A.用托盘天平称取11.7g食盐 B.用量筒量取12.36ml盐酸
C.用酸式滴定管量取21.20ml 0.10mol/L H2SO4溶液
D.用200ml容量瓶配制500ml 0.1mol/L NaCl溶液
Ⅱ.现用物质的量浓度为a mol/L的标准盐酸去测定V mL NaOH溶液的物质的量浓度,请填写下列空白:
(1)酸式滴定管用蒸馏水洗净后,还应该进行的操作是_______________________。
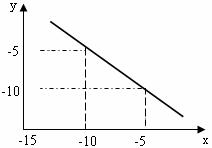
(2)下图是酸式滴定管中液面在滴定前后的读数:

c (NaOH) = _______________________________________。
(3)下列操作会引起测定的NaOH物质的量浓度偏大的是______________
A.若在滴定前滴定管尖嘴部分留有气泡,滴定后滴定管尖嘴部分气泡消失
B.酸式滴定管用蒸馏水洗涤后,直接装盐酸
C.滴定到终点时,仰视读数
D.滴定时,反应容器振荡太激烈,有少量液体溅出
48. 恒温、恒压下,在一个容积可变的容器中发生如下发应:A(g)+B(g)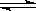 C(g)
C(g)
(1) 若开始时放入1molA和1molB,到达平衡后,生成a molC,这时A的物质的量
为 mol。
(2)若开始时放入3molA和3molB,到达平衡后,生成C的物质的量为 mol。
(3)若开始时放入x molA,2molB和1molC,到达平衡后,A和C的物质的量分别是ymol和3a mol,则x= mol,y= mol。平衡时,B的物质的量 (选填一个编号)
A.大于2 mol B.等于2 mol C.小于2 mol D.可能大于、等于或小于2mol
47.某温度时,测得0.001mol/L的NaOH溶液的pH为11,则该温度下的KW=________
在此温度下,将pH=a的NaOH溶液VaL与pH=b的H2SO4溶液VbL混合
(1)若所得混合溶液为中性,a=12,b=2,则Va:Vb=_____________
(2) 若所得混合溶液为中性,a+b=12,则Va:Vb=_____________
(3) 若所得混合溶液的pH=10,且a=12,b=2,则Va:Vb=_____________
46.(1)pH=13的强碱和pH=2的强酸混合,所得溶液的pH=11,那么强碱和强酸的体积比______________________
(2)若1体积硫酸恰好与10体积pH=11的NaOH的溶液完全反应,则二者物质的量浓度之比应为______________
(3)pH=11的Na2CO3溶液中水电离的OH-的浓度为a,pH=4的NaHSO4溶液中,水电离的OH-的浓度为b,则a:b=_________
(4)某HCl溶液pH=a,某NaOH溶液pH=b,取V1L盐酸溶液与NaOH溶液中和,需V2LNaOH溶液,问:
若a+b=14 则V1/V2=____________
若a+b=13 则V1/V2=____________
若a+b=15 则V1/V2=____________
若a+b>14 则V1/V2=___________(填表达式)且V1_______V2(填“>”、“<”或“=”)
45.今含有a:CH3COOH 、b:HCl、 c:H2SO4三种溶液。
(1)当它们的pH相同时,其物质的量浓度的关系是_____________________
(2)当它们的的物质的量浓度相同时,其pH关系是_____________________
(3)中和同一烧碱溶液,需同浓度的三种溶液的体积关系是_______________
(4)体积、浓度相同的a、b、c三溶液,分别与同浓度的NaOH溶液反应使pH等于7,所需NaOH溶液的体积关系是_______________
(5)某温度下,纯水中的c(H+)=2.0x10-7mol/L,则此时溶液中的c(OH-)为__________mol/L
若温度不变,滴入稀盐酸使c(H+)=5.0x10-6mol/L,则c(OH-)为____________mol/L
44.加热蒸干下列溶液,最后得到的物质是什么?请将答案填在相应的地方
AlCl3______________ Fe2(SO4)3_______________ NaHCO3____________
如果将明矾和小苏打溶液混合,则发生反应的离子方程式为______________________
43. 在一定温度下,将2molA和2molB两种气体相混合后于容积为2L的某密闭容器中,发生如下反应3A(g)+B(g)  xC(g)+2D(g),2min末反应达到平衡状态,生成了0.8molD,并测得C的浓度为0.4mol/L,请填写下列空白:
xC(g)+2D(g),2min末反应达到平衡状态,生成了0.8molD,并测得C的浓度为0.4mol/L,请填写下列空白:
(1)x值等于________________
(2)A的转化率为_________________
(3)生成D的反应速率为_________________
(4)如果增大反应体系的压强,则平衡体系中C的质量分数_________
(5)如果上述反应在相同条件下从逆反应开始进行,开始加入C和D各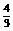 mol,要使平衡时各物质的质量分数与原平衡时完全相等,则还应加入________物质_________mol
mol,要使平衡时各物质的质量分数与原平衡时完全相等,则还应加入________物质_________mol
42.已知:2H2(g) + O2(g) == 2H2O(g);△H= –483.6 kJ· , H2(g) + 1/2O2(g) == H2O(l)的
, H2(g) + 1/2O2(g) == H2O(l)的
△H=–285.8 kJ· ,由此可知,在等温下蒸发45g液态水需吸收_____ kJ的热量。
,由此可知,在等温下蒸发45g液态水需吸收_____ kJ的热量。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com