
题目列表(包括答案和解析)
13.重水D2O的离子积为1.6×10-15,可以用PH一样的定义来规定pD=-lgc(D+),
以下关于pD的叙述正确的是 ( )
A.中性溶液中pD=7
B.在1LD2O的溶液中溶解0.01mol NaOD(设溶液的体积为1L),其中pD=12
C.在1L D2O中溶解 0.01mol DCl(设溶液的体积为1L),其中pD=2
D.在100 mL 0.25mol/L 的DCl重水溶液中加入50 mL 0.2 mol/L的 NaOD的重水溶液,其中pD=1(体积变化忽略不记)
12. 常温下将稀NaOH溶液与稀CH3COOH溶液混合,不可能出现的结果是
A. pH>7, 且c(OH )>c(Na
)>c(Na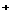 )>c(H
)>c(H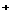 )>c(CH3COO
)>c(CH3COO )
)
B. pH>7, 且c(Na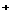 )+ c(H
)+ c(H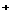 ) =c(CH3COO
) =c(CH3COO )+ c(OH
)+ c(OH )
)
C. pH<7, 且c(CH3COO )>c(H
)>c(H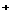 )> c(Na
)> c(Na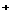 )>c(OH
)>c(OH )
)
D. pH=7, 且c(CH3COO )>c(Na
)>c(Na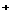 )> c(H
)> c(H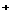 ) = c(OH
) = c(OH )
)
11、在蒸发皿中加热蒸干下列物质的溶液后再充分灼烧(低于400℃),可以得到该物质固体的是
A、硫酸镁 B、小苏打 C、氯化铁 D、亚硫酸钠
10.某原电池总反应离子方程式为 2Fe3++Fe=3Fe2+ ,不能实现该反应的原电池是 A.正极为铜,负极为铁,电解质溶液为FeCl3 溶液 ( )
B.正极为C,负极为Fe,电解质溶液为Fe(NO3)3 溶液
C.正极为Fe,负极为Zn,电解质溶液为Fe2(SO4)3 溶液
D.正极为银,负极为铁,电解质溶液为CuSO4溶液
9. 甲酸的下列性质中,不可以证明它是弱电解质的是 ( )
A.1 mol·L-1甲酸溶液的pH值约为2
B.甲酸能与水以任何比例互溶
C.10mL1 mol·L-1甲酸与10 mL1 mol·L-1NaOH溶液完全反应后,溶液呈碱性
D.在相同条件下,甲酸溶液的导电性比强酸溶液的弱
8. 对于难溶盐MX,其饱和溶液中M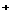 和X
和X 的物质的量浓度之间的关系类似于c(H
的物质的量浓度之间的关系类似于c(H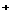 )×c(OH
)×c(OH ) = Kw
, 存在等式c(M
) = Kw
, 存在等式c(M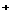 )×c(X
)×c(X ) = Ksp。现将足量AgCl的分别放入下列物质中,AgCl的溶解度大小的排列顺序是
) = Ksp。现将足量AgCl的分别放入下列物质中,AgCl的溶解度大小的排列顺序是
1 20ml 0.01mol/L KCl溶液 2 30ml 0.02mol/L CaCl2溶液
3 40ml 0.03mol/L HCl溶液 4 10ml蒸馏水 5 50ml 0.05mol/L AgNO3溶液
A. 1>2>3>4>5 B. 4>1>3>2>5
C. 5>4>2>1>3 D. 4>3>5>2>1
7、银锌电池广泛用作各种电子仪器的电源,它的充电和放电过程可表示为

Ag2O + Zn + H2O 2Ag + Zn(OH)2,此电池放电时负极上发生反应的物质是
A、Ag B、Zn(OH)2 C、Ag2O D、Zn
6. 已知一种[H+]=1×10-3mol/L的酸和一种[OH-]=1×10-3mol/L的碱溶液等体积混合后溶液呈酸性,其原因可能是: ( )
A.浓的强酸和稀的强碱溶液反应 B.浓的弱酸和稀的强碱溶液反应
C.等浓度的强酸和弱碱溶液反应 D.生成了一种强酸弱碱盐
5. 25℃时,由水电离出c(H+)=1×10-9 mol/L 的溶液中,一定能大量共存的离子组是 ( )
A.Al3+、NH4+、SO42-、Cl- B.Mg2+、K+、SO42-、HCO3-
C.K+、Na+、Cl-、SO42_ D.Ba2+、Cl-、Na+、SO42-
4. 在一定条件下发生下列反应,其中属于盐类水解反应的是 ( )

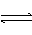
 A.NH4+
+2H2O NH3·H2O + H3O+ B.HCO3-
+ H2O H3O+ + CO32-
A.NH4+
+2H2O NH3·H2O + H3O+ B.HCO3-
+ H2O H3O+ + CO32-
C.HS-+H+═ H2S D.Cl2+H2O H++Cl-+HClO
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com