
题目列表(包括答案和解析)
1.下列过程不属于化学变化的是
A.石油分馏B.烧菜用过的铁锅,经常出现红棕色斑迹
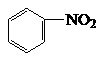
 C.用明矾净化水 D.煤的气化
C.用明矾净化水 D.煤的气化
22.与c(H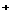 ) × c(OH
) × c(OH )= Kw 类似,FeS饱和溶液中存在FeS(S)
)= Kw 类似,FeS饱和溶液中存在FeS(S) 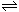 Fe 2+ + S 2- ,
并且有c(Fe 2+) × c(S
2-) = Ksp,常温下Ksp = 8.1×10-17。
Fe 2+ + S 2- ,
并且有c(Fe 2+) × c(S
2-) = Ksp,常温下Ksp = 8.1×10-17。
(1)理论上FeS的溶解度为 。
(2)又知FeS饱和溶液中c(H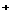 )与c(S 2-)存在以下限量关系:c(S 2-) × [c(H
)与c(S 2-)存在以下限量关系:c(S 2-) × [c(H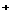 )] 2 = 1.0× 10-22,为了使溶液中c(Fe 2+)达到1mol/L,现将适量FeS投入其饱和溶液中,应调节溶 液中的c(H
)] 2 = 1.0× 10-22,为了使溶液中c(Fe 2+)达到1mol/L,现将适量FeS投入其饱和溶液中,应调节溶 液中的c(H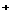 )为
。
)为
。
21.在0.5 mol/L的Na H S O3溶液中滴入石蕊溶液,溶液变红.试回答有关问题:
(1)该溶液中H S O3 离子的电离程度 (填大于,小于或等于) H S O3 离子的 水解程度.溶液中各离子的浓度由大到小的顺序为 .
(2)在Na 2S O3溶液中滴入酚酞, 溶液变红,若在溶液中再滴入过量的氯化钡溶液,所观察到的现象是 .其原因(以离子方程式和简要文字说明): .
(3)在100 mL 含等物质的量NaBr和Na H S O3 的溶液中通入0.01 molCl2 ,有1/2的Br-变为Br2(以知Br2能氧化Na H S O3)。原溶液中NaBr和Na H S O3 的浓度都等于 。
。
20.下图中电极a、b分别为Ag电极和Pt电极,
电极c、d都是石墨电极。通电一段时间后,只在cd
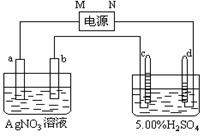 两极上共收集到336mL(标准状态)气体。回答:
两极上共收集到336mL(标准状态)气体。回答:
(1)直流电源中,M为____________极。
(2)Pt电极上生成的物质是________,其质量为___________。C电极上的方程式
(3)电源输出的电子,其物质的量与电极b、c、d分别生成的物质的物质的量之比为:2∶___∶____∶____。
(4)AgNO3溶液的浓度(填增大、减小或不变。下同)_______,
AgNO3溶液的pH____,H2SO4溶液的浓度______,H2SO4溶液的pH______。
19.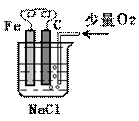 分析右图,按要求写出有关反应方程式:
分析右图,按要求写出有关反应方程式:
(1)铁棒上的电极反应式为:
(2)碳棒上的电极反应式为:
(3)溶液中发生反应的化学方程式:
18. 已知某溶液中只存在OH-、H+、NH4+、Cl-四种离子,某同学推测该溶液中各离子浓度大小顺序可能有如下四种关系:
①c(Cl-)>c(NH4+)>c(H+)>c(OH-) ②c(Cl-)>c(NH4+)>c(OH-)>c(H+)
③c(NH4+)>c(Cl-)>c(OH-)>c(H+) ④c(Cl-)>c(H+)>c(NH4+)>c(OH-)
请填写下列空白
(1)若溶液中只溶解了一种溶质,该溶质的名称是_______________,上述离子浓度大小顺序关系中正确的是_____________(填序号)
(2)若上述关系中③是正确的,则溶液中溶质是____________(填化学式)
(3)若上述关系中④是正确的,则溶液中溶质是____________(填化学式)
17、把AlCl3溶液蒸干后在灼烧,,最后得到的主要固体产物是 ,其理由是(用化学方程式表示,并配以必要的文字说明)
16、配制FeCl2溶液时,即要加 ,其作用是 ;又要加 ,其作用
15.实验室有一瓶混有氯化钠的氢氧化钠固体试剂,经测定NaOH的质量分数约为82.0%,为了验证其纯度,用浓度为0.2mol/L的盐酸进行滴定,试回答下列问题:
(1)托盘天平称量5.0g固体试剂,用蒸馏水溶解于烧杯中,并振荡,然后立即直接转入 500mL容量瓶中,恰好至刻度线,配成待测液备用。请改正以上操作中出现的四处错误分别为 。
(2)将标准盐酸装在25.00mL 滴定管中,调节液面位置在 处,并记下刻度。
(3)取20.00mL待测液待测定。该项实验操作的主要仪器有 。
用 试剂作指示剂时,滴定到溶液颜色由 刚好至
色时为止。
(4)滴定达终点后,记下盐酸用去20.00mL,计算NaOH的质量分数为 。
(5)试分析滴定误差可能由下列哪些实验操作引起的 。
A、转移待测液至容量瓶时,末洗涤烧杯
B、酸式滴定管用蒸馏水洗涤后,直接装盐酸
C、滴定时,反应容器摇动太激烈,有少量液体溅出
D、滴定到终点时,滴定管尖嘴悬有液滴
E、读滴定管开始时仰视,读终点时俯视
14. 某学生设计了一个“黑笔写红字”的趣味实验。滤纸先用氯化钠、无色酚酞的混合液浸湿,然后平铺在一块铂片上,接通电源后,用铅笔在滤纸上写字,会出现红色字迹。据此,下列叙述正确的是
某学生设计了一个“黑笔写红字”的趣味实验。滤纸先用氯化钠、无色酚酞的混合液浸湿,然后平铺在一块铂片上,接通电源后,用铅笔在滤纸上写字,会出现红色字迹。据此,下列叙述正确的是
A.铅笔端作阳极,发生还原反应
B.铂片端作阳极,发生氧化反应
C.铅笔端有少量的氯气产生
D.a点是负极,b点是正极
第Ⅱ卷(非选择题 共72分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com