
题目列表(包括答案和解析)
4.常温下,pH=11的氨水和pH=1的盐酸等体积混合后(不考虑混合后溶液体积的变化),恰好完全反应,则下列说法不正确的是 ( )
A.弱碱的浓度大于强酸的浓度 B.反应后的溶液呈酸性
C.原氨水中有1%的含氮微粒为NH4+
D.反应后的溶液中NH4+、NH3·H2O与NH3三种微粒的平衡浓度之和为0.05mol·L-1
3.某二元酸(化学式用H2A表示)在水中的电离方程式是:H2A = H+ + HA-,
HA- H++A2-,又知0.1mol·L-1NaHA溶液的pH = 2。则下列说法不正确的是( )
H++A2-,又知0.1mol·L-1NaHA溶液的pH = 2。则下列说法不正确的是( )
A.因为A2-+H2O  HA-+OH-,所以Na2A溶液显碱性
HA-+OH-,所以Na2A溶液显碱性
B.0.1mol·L-1 H2A溶液中氢离子的物质的量浓度为0.11 mol·L-1
C.NaHA溶液中各种离子浓度的关系是c(Na+ ) > c(HA-) > c(H+) > c(A2-) > c(OH- )
D.在NaHA溶液中,HA-电离的趋势大于其水解的趋势
2.在元素周期表短周期中的X和Y两种元素可组成化合物XY3,下列说法正确的是( )
A.XY3晶体一定是离子晶体 B.X和Y可属于同一周期,也可属于两个不同周期
C.若Y的原子序数为m,X的原子序数可能是m±4
D.X和Y一定不属于同一主族
1.下列说法或表示正确的是 ( )
A.等质量的硫蒸气和硫固体分别完全燃烧,后者放出热量多
B.由C(石墨)=C(金刚石) △H=+1.19kJ/mol,可知金刚石比石墨稳定
C.在稀溶液中:H+(aq)+OH-(aq)=H2O(l) △H=-57.3kJ/mol,若将含1molCH3COOH的溶液与含1molNaOH的溶液混合,放出的热量小于57.3kJ
D.在101kPa时,2gH2完全燃烧生成液态水,放出285.8kJ热量,氢气燃烧的热化学方程式表示为2H2(g)+O2(g)=2H2O(l) △H=-285.8kJ/mol
27、某气态烃含C85.7%,含H14.3%,在标准状况下的密度是2.5g/L。
该烃能使酸性高锰酸钾溶液或溴水褪色。求该烃的分子式,并写出它的各种同分异构体的结构简式。
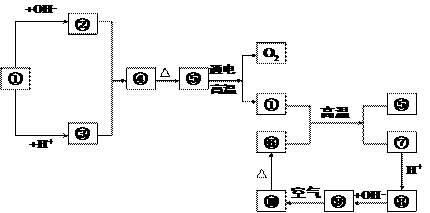 26.下列①-⑩分别代表有关反应中的一种物质,它们均是中学化学中常见物质。已知①-⑤和⑥-⑩分别含有同一种元素:
26.下列①-⑩分别代表有关反应中的一种物质,它们均是中学化学中常见物质。已知①-⑤和⑥-⑩分别含有同一种元素:
(1)分别写出①、④、⑧、⑩的化学式或离子符号:
① ;④ ;⑧ ;⑩ 。
(2)写出下列反应方程式,是离子反应的写出离子方程式:
|
 ① + OH-
① + OH-
 ① + ⑥
① + ⑥
25.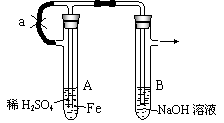 根据下图实验装置和操作,回答有关问题:
根据下图实验装置和操作,回答有关问题:
按右图所示装置进行实验,观察B中现象。
操作(1):先夹止水夹a,使A管开始反应。在B管中观察到的现象 ,B中发生的主要的化学反应有2NaOH + H2SO4 == Na2SO4 + 2H2O,还有 ,
。
操作(2):打开止水夹a,使A管开始反应一段时间后再夹紧a,实验中在B管中观察到的现象是 。
24.
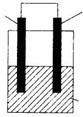 化学电源在通讯、交通以及生活中有着广泛的应用。下图装置由镁条、铝条和某种电解质溶液组成。(1)若电解质溶液为稀硫酸,则原电池的负极为 ,其电极反应式为
,正极现象是
。当导线中有0.6mol电子通过时,消耗负极材料的质量是
g。(2)若电解质为NaOH溶液,则两极的电极反应式分别为:负极 ,正极
。
化学电源在通讯、交通以及生活中有着广泛的应用。下图装置由镁条、铝条和某种电解质溶液组成。(1)若电解质溶液为稀硫酸,则原电池的负极为 ,其电极反应式为
,正极现象是
。当导线中有0.6mol电子通过时,消耗负极材料的质量是
g。(2)若电解质为NaOH溶液,则两极的电极反应式分别为:负极 ,正极
。
23.在配制Al2(SO4)3溶液时,铝离子会部分水解而使溶液呈酸性,水解的离子方程式为: 。为了防止发生水解,可以加入少量的 。
22.在金、钠、铁、铝几种金属中,在空气中最稳定的是 ;最活泼的是 ;既能与酸反应又能与碱反应的是 ;适合于用热还原法冶炼的是 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com