
题目列表(包括答案和解析)
14.已知0.1mol/L的醋酸溶液中存在电离平衡:CH3COOH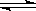 CH3COO-+H+要使溶液中c(H+)/c(CH3COOH)值增大,可以采取的措施是
( )
CH3COO-+H+要使溶液中c(H+)/c(CH3COOH)值增大,可以采取的措施是
( )
A、加少量烧碱溶液 B、升高温度 C、加少量冰醋酸 D、加水
13.在一个1L的密闭容器中加入2molA和1molB,发生下述反应:
2A(g)+B(g)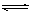 3C(g)+D(s)达到平衡时,C的浓度为1.2mol/L。维持容器的体积和温度不变,按下列四种配比作为起始物质,达到平衡后,C的浓度仍是1.2mol/L的是
( )
3C(g)+D(s)达到平衡时,C的浓度为1.2mol/L。维持容器的体积和温度不变,按下列四种配比作为起始物质,达到平衡后,C的浓度仍是1.2mol/L的是
( )
A. 4molA+2molB B. 3molC+1molD
C. 2molA+1molB+1molD D. 1molA+0.5molB+1.5molC+0.1molD
12.叠氮酸钠(NaN3)是抗禽流感药物“达菲”合成过程中的中间活性物质,3mol NaN3受撞击会生成4mol 氮气和一种离子化合物(Na3N).下列有关叙述错误的是 ( )
A.NaN3受撞击时,NaN3既是氧化剂又是还原剂
B.NaN3跟水反应时,有NH3生成
C.Na3N中N3-半径比Na+半径大
D.NaN3中,既存在离子键又存在非极性共价键
11.Pt(NH3)2Cl2(相对分子质量为300)有两种同分异构体,其顺式结构是临床广泛使用的搞肿
瘤药物。下列有关该物质的说法中正确的是 ( )
A.中心原子的配位数为4 B.含有NH3分子
C.Pt的化合价为+4 D.Pt(NH3)2Cl2是平面四边形结构
10. 用0.100mol·L-1的硫酸溶液滴定20.0mL0.100mol·L-1的氢氧化钡溶液,并绘制酸碱滴
定曲线必须选用的仪器是 ( )
A.pH计 B.胶头滴管 C.滴定管 D.量筒
9.下列各溶液中,微粒的物质的量浓度关系正确的是 ( )
A.10mL 0.5mol/L CH3COONa溶液与6mL 1mol/L盐酸混合:c(Cl-)>c(Na+)>c(H+)>c(OH-)
B.0.1mol/L pH为4的NaHB溶液中:c(HB-)>c(H2B)>c(B2-)
C.在NaHA溶液中一定有:c(Na+)+c(H+)=c(HA-)+c(OH-)+c(A2-)
D.c(NH4+)相等的(NH4)2SO4溶液、(NH4)2CO3溶液和NH4Cl溶液:
c[(NH4)2SO4]<c[(NH4)2CO3]<c(NH4Cl)
8.通过比较归纳可以加深对问题的认识。下列比较或归纳一定正确的是 ( )
A.酸性:H2SO4>H3PO4>H2SiO3 B.稳定性:NH3<PH3<AsH3
C.离子半径:阴离子>阳离子 D.熔沸点:离子化合物>共价化合物
7.下列各项所述的数学不是6的是 ( )
A.在NaCl晶体中,与一个Na+距离最近且相等的Cl-的个数
B.在金刚石晶体,最小的环上的碳原子个数
C.在二氧化硅晶体中,最小的环上的原子个数
D.在石墨晶体的片层结构中,最小的环上的碳原子个数
6.一定条件下,在密闭容器内,SO2氧化成SO3的热化学方程式为:
 2SO2 (g) + O2 (g) 2SO3 (g) ;△H=-a kJ·mol-1在相同条件下,要想得到2a kJ热量,加入各物质的物质的量可能是
( )
2SO2 (g) + O2 (g) 2SO3 (g) ;△H=-a kJ·mol-1在相同条件下,要想得到2a kJ热量,加入各物质的物质的量可能是
( )
A.4molSO2和2molO2 B.5molSO2和3molO2
C.4molSO2和4molO2 D.2molSO2、1molO2和2molSO3
5.已知25℃时,AgI饱和溶液中c (Ag+)为1.22×10-8mol/L,AgCl的饱和溶液中c (Ag+)为1.25×10-5mol/L。若在5mL含有KCl和KI各为0.01mol/L的溶液中,加入8mL0.01mol/LAgNO3溶液,这时溶液中所含溶质的离子浓度大小关系正确的是( )
A.c (K+)>c (NO3-) >c (Cl-) >c (Ag+)>c (I-)
B.c (K+)>c (NO3-) >c (Ag+) >c (Cl-)>c (I-)
C.c (NO3-)>c (K+)>c (Ag+) >c (Cl-)>c (I-)
D.c (K+)>c (NO3-) >c (Ag+) = c (Cl-) + c (I-)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com