
题目列表(包括答案和解析)
12、若某电能与化学能的转化装置(电解池或原电池)中发生的总反应的离子方程式是 Cu + 2H+ ===Cu2+ + H2 ↑,则下列关于该装置的有关说法正确的是
A.该装置可能是原电池,也可能是电解池
B.该装置只能是原电池,且电解质溶液为硝酸
C.该装置只能是电解池,且金属铜为该电解池的阳极
D.该装置只能是原电池,电解质溶液不可能是盐酸
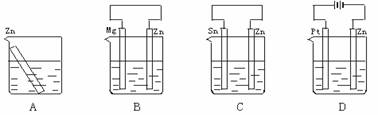
10、分别放置在下图所示装置(都盛有0.1 mol·L-1的H2SO4溶液)中的四个相同的纯锌片,腐蚀最慢的是
 11、反应2X(g)+Y(g)
11、反应2X(g)+Y(g) 2Z(g);△H<0(正反应为放热反应)。在不同温度(T1和T2)及压强(P1和P2)下,产物Z的物质的量[n(Z)]与反应时间(t)的关系如图所示。则下列判断正确的是
2Z(g);△H<0(正反应为放热反应)。在不同温度(T1和T2)及压强(P1和P2)下,产物Z的物质的量[n(Z)]与反应时间(t)的关系如图所示。则下列判断正确的是
A.T1<T2,P1<P2
B.T1<T2,P1>P2
C.T1>T2,P1>P2
D.T1>T2,P1<P2
9、为了除去MgCl2酸性溶性中的Fe3+,可在加热搅拌的条件下加入一种试剂,过滤后再加入适量盐酸.这种试剂是
A.NH3·H2O B.NaOH C.Na2CO3 D.MgCO3
8、强酸和强碱在稀溶液中的中和热可表示为:
H+(aq)+OH-(aq)=H2O(l); △H= -57.3 kJ·mol-1,又知在溶液中反应有: CH3COOH(aq)+NaOH(aq)=CH3COONa(aq)+H2O(l); △H=-Q1kJ·mol-1, H2SO4(浓)+NaOH(aq)=Na2SO4(aq)+H2O(l) ; △H= -Q2 kJ·mol-1
HNO3(aq)+KOH(aq) KNO3(aq)+H2O(l) ; △H= -Q3 kJ·mol-1,
KNO3(aq)+H2O(l) ; △H= -Q3 kJ·mol-1,
则Q1、Q2、Q3的关系正确的是 ( )
A. Q1 = Q2 = Q3 B.Q2 > Q1 > Q3 C. Q2 > Q3 > Q1 D. Q2 = Q3 > Q1
7、在一支25mL的酸式滴定管中盛入0.1mol/L HCl溶液,其液面恰好在5mL刻度处。若把滴定管内溶液全部放入烧杯中,再用0.1mol/L NaOH溶液进行中和,则所需NaOH溶液的体积 为
A.大于20mL B.小于20mL C.等于20mL D.等于5mL
6、下列事实不能用勒夏特列原理解释的是
A.将氯化铁溶液加热蒸干最终得不到氯化铁固体
B.钢铁在潮湿的空气中容易生锈
C.温度过高对合成氨不利
D.常温下,将1mLpH=3的醋酸溶液加水稀释至l00mL,测得其pH<5
5、已知反应X+Y= M+N为放热反应,,对该反应的下列说法中正确的
A、X的能量一定高于M
B、Y的能量一定高于N
C、X和Y的总能量一定高于M和N的总能量
D、因该反应为放热反应,故不必加热就可发生
4、在一定温度下的定容密闭容器中,当下列物理量不再改变时,不能表明反应
A(s)+2B(g) C(g)+D(g)已达平衡的是
C(g)+D(g)已达平衡的是
A.混合气体的压强 B.混合气体的密度
C.混合气体的相对分子质量 D.C气体的总物质的量浓度
3、下列变化的熵变大于零的是

 A.H2O(l) H2O(g) B.CO2(g) CO2(s)
A.H2O(l) H2O(g) B.CO2(g) CO2(s)
C.NaOH(aq)+HCl(aq) = NaCl(aq)+H2O D.NH3(g)+HCl(g)=NH4Cl(s)
2、用铁片与稀硫酸反应制取氢气时,下列措施不能使氢气生成速率加大的是
A.加热 B.不用稀硫酸,改用98%浓硫酸
C.滴加少量CuSO4溶液 D.不用铁片,改用铁粉
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com