
题目列表(包括答案和解析)
20.(6分)
(1)
(2) 。
19.(6分)
, 。
23.(10分)黄铁矿(主要成分为FeS2)是工业制取硫酸的重要原料,其煅烧产物为SO2和Fe3O4。(1)将0.050molSO2(g) 0.030molO2(g)放入容积为1L的密闭容器中,反应2SO2(g)+O2(g) 2SO3(g)在一定条件下达到平衡,测得c(SO3)=0.040mol·L-1。
2SO3(g)在一定条件下达到平衡,测得c(SO3)=0.040mol·L-1。
(1)已知上述反应是放热反应,当该反应处于平衡状态时,在体积不变的条件下,下列措施中有利于提高SO2平衡转化的有 (填字母)。
A.升高温度 B.降低温度 C.增大压强
D.减小压强 E.加入催 F.移出氧气
(2)计算该条件下反应的平衡常数K和SO2的平衡转化率(写出计算过程。)
 高二化学上册第二次质量检测题
高二化学上册第二次质量检测题
化学答题卷
命题人:臧峰
22.(15分)已知A、B、C、D、E为五种短周期不同主族的元素,其原子序数依次递增。A、E两种原子最外层电子数之和是B原子最外层电子数的2倍;C、E两种原子最外层电子数之和是D原子最外层电子数的2倍。A、E形成的化合物分子甲中电子总数为18。A原子核内无中子,D是地壳中含量最多的元素。回答下列的问题。
(1)甲的电子式为
(2)工业生产E元素的单质的化学方程式为 。
(3)A单质与C单质在一定条件下可化合为乙,工业生产乙的化学方程式为
(4)A、B两元素也可形成多种化合物,其中分子量最小的分子为丙,用D的单质和丙可以制成燃料电池,电池中装有浓KOH溶液,用多孔的惰性电极浸入浓KOH溶液 在X极通入化合物丙,Y极通入D的单质,则X极是该电池的 极,Y极的电极反应式为 。
21.(9分) 将等物质的量的A、B、C、D4种物质混合,发生如下反应:
aA+ bB 
 c C(s)+dD。当反应进行一段时间后,测得A减少了n mol,B减少了0.5n
mol,C增加了1.5n
mol,D增加了n
mol,此时达到化学平衡。
c C(s)+dD。当反应进行一段时间后,测得A减少了n mol,B减少了0.5n
mol,C增加了1.5n
mol,D增加了n
mol,此时达到化学平衡。
(1)该化学方程式中各物质的系数为:a= ,b= , c= ,d=
(2)若只改变压强,反应速率发生变化,但平衡不发生移动,该反应中各物质的聚集状态:A ,B , D
(3)若只升高温度,反应一段时间后,测知4种物质的物质的量又达到相等,则该反应为 反应。(填“放热”或“吸热”)
20.(6分)已知下列两个热化学方程式;
H2(g)+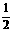 O2(g)==H2O(1) △H = -286 kJ·mol-1
O2(g)==H2O(1) △H = -286 kJ·mol-1
C3H8(g)+5O2(g)==3CO2(g)+4H2O(1) △H = -2220.0 kJ·mol-1
(1)实验测得H2和C3H8的混合气体共5mol,完全燃烧生成液态水时放热5298kJ,则混合气体中H2和C3H8的体积比是 。
(2)已知:H2O(1)=H2O(g) △H = +44.0 kJ·mol-1,写出丙烷燃烧生成CO2和气态水的热化学方程式 。
19.(6分)室温下,测得某溶液中[H+ ]=2×10-7 mol·L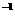 ,则OH-的物质的量浓度为
,该溶液的PH为
(已知lg2=0.3)。
,则OH-的物质的量浓度为
,该溶液的PH为
(已知lg2=0.3)。
18.在密闭容器内放入5molSO2和5molO2,在某温度下经过反应生成2molSO3,此时密闭容器内压强是反应前压强的
A.2倍 B.1.5倍 C.0.9倍 D.0.5倍
第Ⅱ卷 (非选择题 46分)
17. 一定量的混合气体,在密闭容器中发生如下反应:
xA(气)+yB(气) zC(气)达到平衡后,测得A的浓度为0.5 mol·L-1;在恒温下将密闭容器的体积扩大为平衡时的两倍,再达到平衡时,测得A的浓度为0.3 mol·L-1。则下列的叙述正确的是
一定量的混合气体,在密闭容器中发生如下反应:
xA(气)+yB(气) zC(气)达到平衡后,测得A的浓度为0.5 mol·L-1;在恒温下将密闭容器的体积扩大为平衡时的两倍,再达到平衡时,测得A的浓度为0.3 mol·L-1。则下列的叙述正确的是
A.x+y>z B.平衡向右移动
C.B的转化率提高 D.C的百分含量增大
16.碱性电池具有容量大、放电电流大的特点,因而得到广泛应用。锌-锰碱性电池以氢氧化钾溶液为电解液,电池总反应式为:
Zn(s)+2MnO2(s)+H2O(l)==Zn(OH)2(s)+Mn2O3(s)
下列说法错误的是
A.电池工作时,锌失去电子
B.电池正极的电极反应式为:2MnO2(s)+H2O(1)+2e-=Mn2O3(s)+2OH-(aq)
C.电池工作时,电子由正极通过外电路流向负极
D.外电路中每通过0.2mol电子,锌的质量理论上减小6.5g
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com