
题目列表(包括答案和解析)
21.(10分)某校化学研究性学习小组设计实验验证Fe、Cu的金属活动性,他们提出了以下两种方案。请你帮助他们完成有关实验项目:
方案Ⅰ:有人提出将大小相等的铁片和铜片,分别同时放入稀H2SO4(或稀盐酸)中,观察产生气泡的快慢,据此确定它们的活动性。该原理的离子方程式为
。
方案Ⅱ:有人利用Fe、Cu作电极设计成原电池,以确定它们的活动性。试在下面的方框内画出原电池装置图,标出原电池的电极材料和电解质溶液,并写出电极反应式。
正极反应式:
;
负极反应式:
。
结合你所学的知识,帮助他们再设计一个验证Fe、Cu活动性的简单实验方案(与方案Ⅰ、Ⅱ不能雷同): ,
用离子方程式表示其反应原理: 。五、(本题包括2小题,共20分)
17. 反应2X(g)+Y(g) 2Z(g)(正反应为放热反应),在不同温度(T1和T2)及不同压强(P1和P2)下,产物Z的物质的量n(Z)与反应时间(t)的关系如右图中a、b、c三曲线所示。下述判断中正确的是 ( )
反应2X(g)+Y(g) 2Z(g)(正反应为放热反应),在不同温度(T1和T2)及不同压强(P1和P2)下,产物Z的物质的量n(Z)与反应时间(t)的关系如右图中a、b、c三曲线所示。下述判断中正确的是 ( )
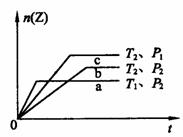 . A.T1>T2;P1<P2 B.T1<T2;P1>P2
. A.T1>T2;P1<P2 B.T1<T2;P1>P2
C.T1>T2;P1>P2 D.T1<T2;P1<P2
|
电池的作用,将化学能转变为电能;而充电时起电解池的作
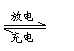 用,将电能转变为化学能贮存起来。某蓄电池充电和放电时
用,将电能转变为化学能贮存起来。某蓄电池充电和放电时
发生的反应为:Fe+NiO2+2H2O Fe(OH)2+Ni(OH)2。关于此蓄电池有下列说法:
①放电时,NiO2为正极;②充电时,阳极反应式为:Fe(OH)2+2e-= Fe+2OH-;
③放电时,电解质溶液中的阳离子向正极方向移动;
④充电时,Ni(OH)2的反应式为:Ni(OH)2-2e-= NiO2+2H+;
⑤蓄电池的电极必须浸在碱性电解质溶液中;
其中正确的组合是 ( )
A.②③④ B.①②③ C.②④⑤ D.①③⑤
|
. 19.(8分)在某温度下,A+B 2C类型的反应达到平衡:
19.(8分)在某温度下,A+B 2C类型的反应达到平衡:
(1)若升高温度时,C的浓度减小,则正反应是 热反应,在升高温度时,正反应速率 (填“增大”、“减小”或“不变”,下同),逆反应速率 。
(2)在增加或减少B物质时,平衡不移动,则B物质为 态。
(3)若A为气态物质,增大压强平衡不移动,则B的物质为 态,C为 态。
(4)若加入正催化剂,平衡 移动,达到平衡状态的时间 (填“延长”、“缩短”或“不变”)。
 20.(10分)某学生用0.1000 mol·L-1标准氢氧化钡溶液滴定未知浓度的盐酸溶液,其操作可分解为如下几步:
20.(10分)某学生用0.1000 mol·L-1标准氢氧化钡溶液滴定未知浓度的盐酸溶液,其操作可分解为如下几步:
A.取20.00 mL待测盐酸溶液注入洁净的锥形瓶中,并加入2~3滴
酚酞试液
B.用标准氢氧化钠溶液润洗滴定管2~3次
C.把盛有标准氢氧化钠溶液的碱式滴定管固定好,调节滴定管尖嘴使
之充满溶液
D.取标准氢氧化钠溶液注入碱式滴定管至“0”刻度以上2~3mL处
E.调节液面至“0”或“0”刻度以下,记下读数
|
回答下列问题:
(1)正确的操作顺序是:B、 、F(填序号)
(2)上述B步骤操作的目的是 ;
(3)上述A步骤操作之前,若先用待测溶液润洗锥形瓶,则对滴定结果的影响是
(填“偏大”或“偏小”或“无影响”);
(4)判断到达滴定终点的实验现象是 ;
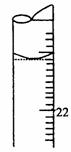
(5)若滴定结束时,滴定管液面如图所示,则终点读数为 mL。
16.在物质的量浓度均为0.01 mol·L-1的CH3COOH和CH3COONa的混合液中,测得
c(CH3COO-)>c(Na+),则下列关系正确的是 ( )
A.c(H+)=c(OH-) B.c(H+)<c(OH-)
C.c(CH3COOH)>c(CH3COO-)
D.c(CH3COOH)+c(CH3COO-)=0.02mol·L-1
15.某溶液中加入铝片有氢气产生,则在该溶液中一定能够大量共存的离子组是 ( )
A.. S2-、NO3-、Ba2+、Na+ B.Na+、K+、SO42-、Cl-
C.NH4+、Ba2+、Cl-、HCO3- D.SO42-、CH3COO-、Al3+、Mg2+
14.下列操作中,能使水的电离平衡向右移动,而且使所得溶液显酸性的是 ( )
A.在水中加入少量氯化钠,并加热到100℃
B.在水中滴人稀硫酸
C.在水中加入小苏打
D.在水中加入氯化铝固体
13.下列反应的离子方程式书写正确的是 ( )
A.在碘化亚铁溶液中通入足量Cl2 2Fe2++2I-+2Cl2 2Fe3++I2+4Cl-
B.在AlCl3溶液中加入Na[Al(OH)4]溶液 Al3++[Al(OH)4]-+3H2O 2Al(OH)3↓
C.氯化铵在水溶液中水解 NH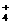 +H2O
+H2O NH3·H2O+H+
D.硫酸铁溶液中加入过量氨水 Fe3++3NH3·H2O Fe(OH)3↓+3NH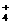
12.下列说法不正确的是 ( )
A.pH=3的醋酸与pH=11的NaOH溶液等体积混合后,溶液的pH一定小于7
B.pH<7的溶液一定是酸溶液
C.pH=5的溶液和pH=3的溶液相比,前者c(OH-)是后者的100倍
D.在1mol·L-1的氨水中,改变外界条件使c(NH4+)增大,溶液的pH不一定增大
11.下列说法中正确的是 ( )
A.在相同条件下,若将等量的硫蒸气和硫固体分别完全燃烧,后者放出热量多
B.由“C(石墨) = C(金刚石);△H = +1.9kJ·mol-1”可知,金刚石比石墨稳定
C.在稀溶液中:H+(aq)+OH-(aq)=H2O(l);△H=-57.3kJ·mol-1,若将含0.5mol H2SO4的浓硫酸与1mol NaOH溶液混合,放出的热量大于57.3 kJ
D.在101Kpa时,2g H2完全燃烧生成液态水,放出285.8kJ热量,氢气燃烧的热化学方程式表示为:2H2(g)+O2(g)=2H2O(l);△H= +285.8kJ·mol-1
9.下列措施一定能使反应速率加快的是 ( )
①增加反应物的物质的量 ②升高温度 ③缩小反应容器体积 ④加入生成物
⑤加入MnO2
A.全部 B.①②⑤ C.② D.②③
|
A.Fe-2e-= Fe2+ B.2H2O+O2+4e-= 4OH-
C.2H++2e-= H2↑ D.4OH--4e-=2H2O+O2↑
8.可以判定某酸HA是弱电解质的事实是 ( )
A.其盐溶液呈酸性 B.该酸可溶解Cu(OH)2
C.该酸可以 CaCO3反应放出CO2 D.室温时0.01mol·L-1HA溶液pH = 4
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com