
题目列表(包括答案和解析)
1. 下列作用不属于水解反应的是
A.吃馒头时多咀嚼后有甜味
B.淀粉溶液和稀硫酸共热一段时间后,滴加碘水不显蓝色
C.不慎将浓硝酸沾到皮肤上会出现黄色斑痕
D.油脂与氢氧化钠溶液共煮后可以制得肥皂
15.碱性锌锰干电池中发生的总化学反应方程式为Zn + 2MnO2+ H2O = Zn(OH)2 + Mn2O3,试计算每放出1 600C的电量所需要的负极材料的质量(单位g)。
14.一个完整的氧化还原反应方程式可以拆分,写成两个“半反应式”,一个是“氧化反应”式,一个是“还原反应”式。如2Fe3++Cu=2Fe2++Cu2+可以写成:氧化反应:Cu-2e- =Cu2+;还原反应: 2Fe3++2e- =2Fe2+。
(1) 根据以上信息将反应3NO2+H2O=2H++2 +NO拆分为两个“半反式”:氧化反应:
;还原反应
。
+NO拆分为两个“半反式”:氧化反应:
;还原反应
。
(2) 已知某一反应的半反应式为CH4+10OH--8e- =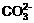 +7H2O;4H2O+2O2+8e- =8OH-,则总反应为
。
+7H2O;4H2O+2O2+8e- =8OH-,则总反应为
。
13.熔融盐燃料电池具有高的发电效率因而受到重视。可用Li2CO3和Na2CO3的熔融盐混合物作电解质,CO为阳极燃气,空气与CO2的混合气为阴极助燃气,制得在650℃下工作的燃料电池。完成有关的电池反应式:阳极反应式:2CO+2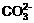 =4CO2+4e-
=4CO2+4e-
阴极反应式:
总电池反应式:
12.从铜、铁及碳棒中选取合适的电极材料设计一个原电池,实现反应:
3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O。
负极为 ,电极反应方程式为 ,
正极应选 ,电极反应方程式为 。
11.铅蓄电池是最普通的二次电源,其电极材料分别是Pb和PbO2,电解质溶液为稀硫酸。工作时,该电池的总反应为PbO2+Pb+2H2SO4=2PbSO4+2H2O根据上述情况判断
(1)蓄电池的负极是 ,其电极反应方程式为 。
(2)蓄电池的正极是 ,其电极反应方程式为_ ____。
(3)蓄电池工作时,其中电解质溶液的pH______(填“增大”、“减小”、“不变”)。
10.某可充电的锂离子电池以LiMn2O4为正极,嵌入锂的碳材料为负极,含Li+导电固体为电解质。放电时的电池反应为:Li+LiMn2O4=Li2Mn2O4。下列说法正确的是( )
A.放电时,LiMn2O4发生氧化反应
B.放电时,正极反应为:Li++LiMn2O4+e- =Li2Mn2O4
C.充电时,LiMn2O4发生氧化反应
D.充电时,阳极反应为:Li++e- =Li
9.锂离子电池已经成为新一代实用化的蓄电池,该电池具有能量密度大、电压高的特性。锂离子电池放电时的电极反应式为
负极反应:C6Li-x e-=C6Li1-x+xLi+(C6Li表示锂原子嵌入石墨形成复合材料)
正极反应:Li1-xMO2+xLi++x e-=LiMO2(LiMO2表示含锂的过渡金属氧化物)
下列有关说法正确的是( )
A.锂离子电池充电时电池反应为C6Li+Li1-xMO2=LiMO2+C6Li1-x
B.电池反应中,锂、锌、银、铅各失去1 mol电子,金属锂所消耗的质量最小
C.锂离子电池放电时电池内部Li+向负极移动
D.锂离子电池充电时阴极反应为C6Li1-x+xLi++x e-=C6Li
8.一种新型的燃料电池,它以多孔镍板为电极插入KOH溶液中,然后分别向两极通入乙烷和氧气,其总反应为:2C2H6 +7O2+8KOH====4K2CO3+10H2O,有关此电池的推断正确的是( )
A.正极反应为14H2O+7O2+28e-====28OH-
B.放电一段时间后,负极周围的pH升高
C.每消耗1 mol C2H6 ,则电路上转移的电子为14 mol
D.放电过程中KOH的物质的量浓度不变
7.碱性电池具有容量大、放电电流大的特点,因而得到广泛应用。锌-锰碱性电池以氢氧化钾溶液为电解液,电池总反应式为: Zn(s)+2MnO2(s)+H2O(l)==Zn(OH)2(s)+Mn2O3(s)
下列说法错误的是( )
A.电池工作时,锌失去电子
B.电池正极的电极反应式为:2MnO2(s)+H2O(1)+2e-=Mn2O3(s)+2OH-(aq)
C.电池工作时,电子由正极通过外电路流向负极
D.外电路中每通过0.2mol电子,锌的质量理论上减小6.5g
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com