
题目列表(包括答案和解析)
3、常见碱在生产生活中的应用
Ca(OH)2是一种常见的廉价的应用广泛的碱,它有消石灰、熟石灰等俗名,可用于建筑、改良酸性土壤,与CuSO4溶液混合制作农药波尔多液,处理工厂排放的酸性气体及含量重金属盐的废水等方面。在中考试题中已出现“知识与生产实际、与环境保护相结合,能力与实验操作、方案评价和实验设计相结合”的趋势。
[例3](2009·青岛)某化学实验室有一瓶失去标签的碱溶液,可能是氢氧化钠或氢氧化钙溶液;小王同学认为是氢氧化钙溶液。请你按小王同学的猜想,进行下列实验探究,并按要求填写下表:
|
猜想 |
实验步骤 |
实验现象 |
结论与相应的化学方程式 (若不反应可不写化学方程式) |
|
可能 是氢 氧化 钙溶 液 |
方案Ⅰ: 用试管取约2mL该溶液,向其中滴加几滴 ____________溶液 |
_____________ |
该溶液是_______________, 化学方程式: __________________________ |
|
方案Ⅱ:(选用与方案Ⅰ 不同类别的其他物质) |
|
____________________ |
_____________ |
该溶液是_______________, 化学方程式: __________________________ |
[答案]方案Ⅰ:碳酸钠 生成白色沉淀 氢氧化钙溶液
Na2CO3+ Ca(OH)2= CaCO3↓+2NaOH
方案Ⅱ:用试管取约2mL该溶液,向其中通入二氧化碳气体
生成白色沉淀 氢氧化钙溶液 Ca(OH)2 + CO2 == CaCO3↓+ H2O
[解析]氢氧化钠与二氧化碳反应生成碳酸钠和水,反应现象不明显,而氢氧化钙与二氧化碳反应生成碳酸钙沉淀和水,所以可以用二氧化碳鉴别氢氧化钠和氢氧化钙;而且氢氧化钠和碳酸钠不反应,氢氧化钙却与碳酸钠反应生成碳酸钙沉淀,所以也可以用碳酸钠来鉴别氢氧化钠和氢氧化钙。
[规律小结]氢氧化钠和氢氧化钙同属于碱,具有碱的通性,但二者的区别在于能否与二氧化碳和碳酸钠反应有明显现象。
变式训练三
2、氢氧化钠、氢氧化钙的化学性质
(1)氢氧化钠的化学性质
1与指示剂反应:其溶液能使石蕊试液变蓝、酚酞试液变红
2与非金属氧化物反应:
2NaOH +CO2=Na2CO3+H2O 2NaOH +SO3=Na2SO4+H2O

3与酸反应(中和反应):
NaOH + HCl = NaCl + H2O 2NaOH+H2SO4=Na2SO4+2H2O
4与某些盐的反应
CuSO4+2NaOH=Cu(OH)2↓+Na2SO4
FeCl3 +3NaOH =Fe(OH)3↓+3NaCl 
(2)氢氧化钙的化学性质
1与指示剂反应:其溶液能使石蕊试液变蓝、酚酞试液变红
2与非金属氧化物反应:Ca(OH)2+CO2=CaCO3↓+H2O 
3与酸反应(中和反应):
Ca(OH)2+2HCl=CaCl2+2H2O Ca(OH)2+H2SO4=CaSO4+2H2O
4与某些盐的反应:Ca(OH)2+Na2CO3=CaCO3↓+2NaOH
注意:(1)NaOH必须密封保存,碱液不能存在玻璃瓶塞的试剂瓶中()
(2)由于NaOH易溶,Ca(OH)2微溶,常温下,NaOH溶液浓度比Ca(OH)2溶液浓度大得多,故实验室用NaOH吸收CO2,而仅用Ca(OH)2溶液检验CO2。
1、氢氧化钠和氢氧化钙的物理性质
(1)氢氧化钠俗称苛性钠、火碱、烧碱,是白色块状固体;易溶于水,溶解时放出大量的热;,在空气中放置会吸水溶解而在表面形成溶液,这种现象称为潮解。因此氢氧化钠可作为某些气体的干燥剂,如干燥H2、O2、CO、CH4、NH3等;但不可以干燥CO2、HCl等气体,因为它们会发生化学反应。
实验室常用氢氧化钠和生石灰的混合物制成干燥剂,俗称碱石灰。
氢氧化钠有涩味和滑腻感,有强烈的腐蚀性,若不慎将碱夜沾到皮肤或衣服上要用大量的水冲洗,再涂上硼酸溶液
(2)氢氧化钙俗称消石灰、熟石灰,是一种白色粉末状固体,微溶于水,有腐蚀性。氢氧化钙可有生石灰与水反应制得,方程式为CaO+H2O=Ca(OH)2,该反应放出大量的热,可将鸡蛋煮熟。
2、(2009·临沂)分别将盛有浓盐酸、浓硫酸、固体氢氧化钠、固体氯化钠的试剂瓶,敞口放置一段时间后,试剂质量减少的是
,试剂质量增加而且变质的是
(填写试剂名称)。
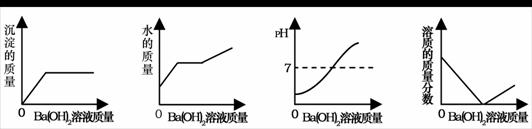
1、(2009·烟台)向装有50g稀硫酸的小烧杯中,不断慢慢滴加10%的Ba(OH)2溶液至过量。小烧杯中有关量的变化情况见下图。其中肯定不正确的是( )

2、几种常见的酸
(1)盐酸(HCl)
物理性质:无色液体,易挥发,有刺激性气味,在空气中形成白雾。(盐酸越浓越易挥发)
化学性质
1跟指示剂的反应:使紫色石蕊试液变红;遇无色酚酞试液不变色。
2跟金属反应:2HCl+Zn=ZnCl2+H2↑ 
3跟金属氧化物的反应:Fe2O3 +6HCl
= 2FeCl3+ 3H2O
4跟碱反应:HCl + NaOH = NaCl + H2O
5跟某些盐的反应:HCl + AgNO3 = AgCl↓+
HNO3
(2)硫酸(H2SO4)
物理性质:无色液体,无挥发性,无气味,粘稠油状。
化学性质
1跟指示剂的反应:使紫色石蕊试液变红;遇无色酚酞试液不变色。
2跟金属反应:H2SO4+Zn=ZnSO4+H2↑
3跟金属氧化物的反应:Fe2O3+ 3H2SO4=
Fe2(SO4)3 + 3H2O
4跟碱反应:H2SO4 + Cu(OH)2=CuSO4+
2H2O
5跟某些盐的反应:H2SO4+
BaCl2=BaSO4↓+2HCl
[例2](2009·常州)程明和王刚不小心将纯碱洒到白醋(其有效成分为醋酸,可用HAc表示)里,发现有大量气泡产生,这使他们对醋酸产生了新认识:醋酸像盐酸一样,能与纯碱反应;此外,他们通过查阅相关资料,还检索到以下信息:①醋酸与盐酸都具有较强挥发性;②醋酸是一种有机酸,具有酸的通性,且其钠盐(NaAc)受热不易分解;③盐酸与纯碱的反应分以下两步进行:
Ⅰ.Na2CO3+HCl===NaHCO3+NaCl;Ⅱ.NaHCO3+HCl===NaCl+H2O+CO2↑ 
试根据以上信息回答下列问题:
(1)醋酸可以使紫色石蕊试液变 ;
(2)根据信息①可知醋酸应置于阴凉处 保存;
(3)试写出醋酸与纯碱第一步反应的化学方程式: ;
(4)他们向纯碱溶液中滴加醋酸到不再产生气泡后,将所得溶液蒸发结晶,获得了少量白色固体。王刚认为这就是纯净的NaAc,而程明则认为里面含有HAc。你认为 的观点正确,理由是: 。
[答案](1)红 (2)密封
(3)Na2CO3+HAc==NaHCO3+NaAc
(4)王刚(1分) 由于HAc具有挥发性,在蒸发过程中已经挥发掉
[解析]醋酸具有酸的通行,说明醋酸也可以是紫色石蕊试液变红色;由于醋酸易挥发,所以必须密封保存;醋酸具有酸的通性,可以和盐酸一样与碳酸钠反应。
[规律小结]酸在水溶液中电离生成的阳离子全是氢离子,所以不同的酸具有相似的化学性质。酸的共同性质实质上是反映着氢离子的性质。
酸的通性可归纳以下五点:
|
酸的通性 |
一般规律 |
|
|
(1) |
跟指示剂反应 |
紫色石蕊试液遇酸变红色无色酚酞试 无色酚酞试液遇酸不变色 |
|
(2) |
跟活泼金属起置换反应 |
酸+金属→盐+氢气 |
|
(3) |
跟碱性氧化物反应 |
酸+碱性氧化物→盐+水 |
|
(4) |
某些盐反应 |
酸+盐→新酸+新盐 |
|
(5) |
跟碱起中和反应 |
酸+碱→盐+水 |
变式训练二
1、浓盐酸和浓硫酸的性质
(1)浓盐酸具有挥发性,打开盛有浓盐酸的试剂瓶,会观察到瓶口有白雾出现,这是由挥发出的氯化氢气体与空气中的水蒸气液化成小液滴的缘故。
(2)1浓硫酸具有吸水性,故可作干燥剂,可以干燥H2、O2、CO2、CO等气体,但不可以干燥NH3、H2S等气体,因为硫酸可以与它们发生反应。
2浓硫酸具有脱水性,能将纸张、木材、布料、皮肤等有机化合物中的氢、氧元素以水的组成比脱去而生成黑色的炭。
3因浓硫酸具有强烈的腐蚀性,如果不慎将浓硫酸沾在皮肤或衣服上,应立即用水冲洗,然后涂上3%-5%的碳酸氢钠溶液。
4浓硫酸的稀释。由于浓硫酸溶于水时放出大量的热,因而在稀释浓硫酸时,一定要把浓硫酸沿着器壁慢慢地注入水里,并不断搅动,使产生的热量迅速地扩散。切不可把水倒进浓硫酸里。
3、(2009·黔东南州)小明在凉拌紫甘蓝时,加入一些食醋,发现紫甘蓝变红了。他想这是不是巧合呢?于是又取紫甘蓝的汁液重复加食醋,现象相同,他又在紫甘蓝汁液中加入一些纯碱,结果发现紫甘蓝汁液变绿,请你和小明一起解决下列问题:
(1)食醋的pH 7(填“<”“=”或“>”), 纯碱属于 (填“酸”、“碱”或“盐”)类化合物。 21世纪教育网
21世纪教育网
(2)结合小明的实验,请你联想紫甘蓝汁液的用途
。
2、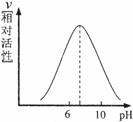 (2009·南京)酶是一类重要的蛋白质,能催化生物体内的反应。某同学用查阅资料的方法研究pH对某种酶催化活性的影响,结果如图所示。据图推测,这种酶催化活性最佳的pH约为( )
(2009·南京)酶是一类重要的蛋白质,能催化生物体内的反应。某同学用查阅资料的方法研究pH对某种酶催化活性的影响,结果如图所示。据图推测,这种酶催化活性最佳的pH约为( )
A.pH=0
B. 1<pH<6
C.6.5<pH<8 D.10<pH<14
1、(2009·达州)生活中常见的三种物质:①柠檬汁,②肥皂水,③食盐水。柠檬汁能使紫色石蕊试液变红,肥皂水显碱性,食盐水的pH=7。它们的pH由小到大排列,正确的是( )
A.①②③ B.①③② C.②①③
D.③①②
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com