
题目列表(包括答案和解析)
22.(8分)将1L一定浓度的CuSO4溶液用a、b两个石墨电极电解,当a极上产生22.4L(标准状况)气体时,b极上只有固体析出。然后将电极与电源反接继续通电,b极上又产生22.4L(标准状况)气体,溶液质量共减轻227g。计算:
(1)第一次电解时,b极增加的质量
(2)原溶液的物质的量浓度
高二化学(选修)答卷纸
姓名: 得分:
选择题答题栏:
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
|
|
|
|
|
|
|
|
|
|
9 |
10 |
11 |
12 |
13 |
14 |
15 |
16 |
|
|
|
|
|
|
|
|
|
21.(19分)(1)已知:反应CH3C≡CCH3+2H2→CH3(CH2)2CH3 △H=-278kJ/mol
反应CH2=CH-CH=CH2+2H2→CH3(CH2)2CH3 △H=-239kJ/mol
提示:化学反应总是向能量降低的方向进行
如果CH3CHBrCHBrCH3与NaOH醇溶液共热后的主要产物是A,
A的结构简式为
(2)某有机化合物X(C12H13O6Br)遇FeCl3溶液显紫色,其结构简式如下
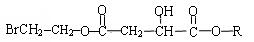
X在足量的NaOH水溶液中加热反应得到A、B、C、D四种物质,A中有两种氢原子,C中只有一种氢原子。D不含氢原子。则A、B、C的结构简式为:
A ,B ,C 。D
(3)化学式为C5H4的烃,理论上同分异构体的数目可能有30多种。如:
① CH2=C=C=C=CH2 ② CH≡C-CH=C=CH2
③  ④
④  -C≡CH ⑤
-C≡CH ⑤
 -CH=CH2……
-CH=CH2……
请不要顾忌这些结构能否稳定存在,完成下面各小题:
Ⅰ、异构体①、②是链状分子,请再写出2种链状分子的结构简式:
,_______________ _______。
Ⅱ、若核磁共振表明氢原子的化学环境没有区别,则满足条件的异构体
除①、③外还有 _____ ____ 。(只需答出一例的结构简式)
20、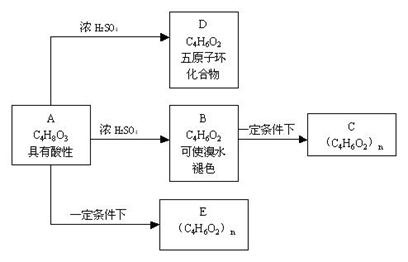 (13分)化合物C和E都是医用功能高分子材料,且有相同的元素百分组成,均可由化合物A(C4H8O3)制得,如下图所示,B和D互为同分异构体。
(13分)化合物C和E都是医用功能高分子材料,且有相同的元素百分组成,均可由化合物A(C4H8O3)制得,如下图所示,B和D互为同分异构体。
试写出: ⑴化学方程式A→D , B→C , ⑵反应类型: A→B ,B→C , A→E ,
⑶E的结构简式: ;
A的结构简式的同分异构体(同类别且有支链)的结 构简式: 及
19.(10分)到目前为止,由化学能转变的热能或电能仍然是人类使用最主要的能源。
⑴ 化学反应中放出的热能(焓变,ΔH)与反应物和生成物的键能(E)有关。
已知:H2(g)+Cl2(g)=2HCl(g) ΔH=-185kJ/mol
E(H-H)=436 kJ/mol,E(Cl-Cl)=247 kJ/mol
则E(H-Cl)= ;
⑵ 已知:Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) ΔH=-25kJ/mol
3 Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g) ΔH=-47kJ/mol
Fe3O4(s)+CO(g)=3FeO(s)+CO2(g) ΔH=+19kJ/mol
请写出CO还原FeO的热化学方程式: ;
⑶ 有下图所示的装置:
该装置中Cu极为 极;当铜片的质量变化为12.8 g时,a极上消耗的O2在标准状
况下的体积为
L.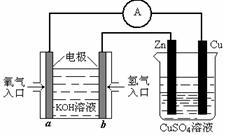
18.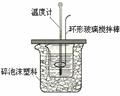 (10分)某实验小组设计用50 mL1.0mol/L盐酸跟50mL1.1mol·L-1
(10分)某实验小组设计用50 mL1.0mol/L盐酸跟50mL1.1mol·L-1
氢氧化钠溶液在下图装置中进行中和反应。在大烧杯底部垫泡沫塑料(或纸条),使放入的小烧杯杯口与大烧杯杯口相平。然后再在大、小烧杯之间填满碎泡沫塑料(或纸条),大烧杯上用泡沫塑料板(或硬纸板)作盖板,在板中间开两个小孔,正好使温度计和环形玻璃搅拌棒通过。通过测定反应过程中所放出的热量可计算中和热。试回答下列问题:
(1)本实验中用稍过量的NaOH的原因教材中说是为保证盐酸完全被中和。试问:盐酸在反应中若因为有放热现象,而造成少量盐酸在反应中挥发,则测得的中和热数值 (填偏高、偏低或不变);
(2)该实验小组做了三次实验,每次取溶液各50mL,并记录如下原始数据。
|
实验序号 |
起始温度t1/℃ |
终止温度(t2)℃ |
温差(t2-t1)℃ |
||
|
盐酸 |
NaOH溶液 |
平均值 |
|||
|
1 |
25.1 |
24.9 |
25.0 |
31.6 |
6.6 |
|
2 |
25.1 |
25.1 |
25.1 |
31.8 |
6.7 |
|
3 |
25.1 |
25.1 |
25.1 |
31.9 |
6.8 |
已知盐酸、NaOH溶液密度近似为1.00g/cm3中和后混和液的比热容 C=4.18J(g.·℃)则该反应的中和热为△H=___________________________________;
(3)若用等浓度的醋酸与NaOH溶液反应,则测得的中和热的数值会 (填偏高、偏低或不变),其原因是 ;
(4)在中和热测定实验中存在用水洗涤温度计上的盐酸溶液的步骤,试分析此操作步骤对实验测定中和热的影响 。(只需答出一例)
|
甲 |
HCOOCH2CH3 HCOOH C6H5OH |
|
乙 |
[Ag(NH3)2]OH CH3CH2OH NaOH |
17.(1) (4分)有甲、乙
两组物质
甲组中的 能跟乙组中的所有物质发生反应;
乙组中的 也能跟甲组的所有物质发生反应。
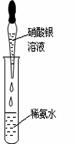
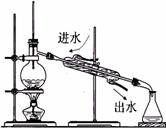
(2)(8分)下列图示的装置或操作中均有1~2处明显的错误,用简洁的语言指出错误,将其填入对应装置下方的空格中。
|
①银氨溶液 的配制 |
②实验室蒸馏石油 |
③测定乙醇跟钠反应放出氢气体积的装置 |
④测醋酸溶液的PH |
 |
 |
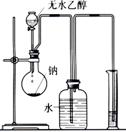 |
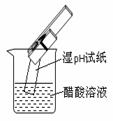 |
|
|
|
|
|
16.高铁电池是一种新型可充电电池,与普通高能电池相比,该电池长时间保持稳定的放电
电压。高铁电池的总反应为:3Zn + 2K2FeO4 + 8H2O 3Zn(OH)2
+ 2Fe(OH)3 + 4KOH,
3Zn(OH)2
+ 2Fe(OH)3 + 4KOH,
下列叙述不正确的是
A、放电时负极反应为:Zn-2e-+2OH-=Zn(OH)2
B、放电时正极反应为:Fe(OH)3 -3e-+5OH-=FeO42-+4H2O
C、放电时每转移3mol电子,正极有1mol K2FeO4被氧化
D、放电时正极附近溶液的碱性增强
15.下列反应可由1,3-丁二烯制备酒石酸 HOOC-CH(OH)-CH(OH)-COOH的正确流程是
A.加成、取代、氧化、加成、氧化 B、加成、取代、加成、氧化、氧化、取代
C.加成、取代、氧化、氧化、加成 D、加成、氧化、取代、氧化、加成、取代
14、下列各组混合物无论以何种比例混合,只要总的物质的量一定,完全燃烧时消耗氧气的量
是定值的是
A、CH2=CH2、C2H5OH、HOCH2CH2COOH B 、 CH2O、C2H4O2、C6H12O6
C、C6H6、C5H10、C7H6O2 D 、 H2、CO、CH3OH
13.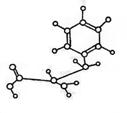 下图是某有机物(由C、H、O、N四种元素组成)的球棍模型,下列关于
下图是某有机物(由C、H、O、N四种元素组成)的球棍模型,下列关于
该有机物的性质叙述中错误的是
A.能与NaOH溶液发生反应,也能与盐酸反应 B.能发生加成反应
C.能合成高分子化合物 D.能发生水解反应
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com