
题目列表(包括答案和解析)
19.已知:N2(g)+3H2(g)  2NH3(g);△H= -92.4kJ/mol,在相同温度下,向一密闭容器中通入0.6mol N2、1.8mol H2和0.8mol NH3达平衡时反应的热效应(即放出或吸收的热量)为QlkJ;向另一体积相同的密闭容器中通入0.5mol N2和1.5mol H2、lmol NH3,达到平衡时反应的热效应为Q2kJ,则下列判断一定错误的是
2NH3(g);△H= -92.4kJ/mol,在相同温度下,向一密闭容器中通入0.6mol N2、1.8mol H2和0.8mol NH3达平衡时反应的热效应(即放出或吸收的热量)为QlkJ;向另一体积相同的密闭容器中通入0.5mol N2和1.5mol H2、lmol NH3,达到平衡时反应的热效应为Q2kJ,则下列判断一定错误的是
A.Q2<Ql<92.4 B.Q1=Q2=92.4 C.Q1<Q2<92.4 D.Q1=Q2<92.4
18.下列实验事实不能证明醋酸是弱酸的是
A.常温下,测得醋酸钠溶液的pH>7
B.常温下,测得0.1mol/L醋酸溶液的pH=4
C.常温下,将pH=1的醋酸溶液稀释1000倍,测得pH<4
D.常温下,将物质的量浓度相同的醋酸溶液与氢氧化钠溶液等体积混合后恰好中和
17.下列各条件下可能共存的离子组是
A.某无色溶液中:NH4+、Na+、Cl-、MnO4-
B.由水电离出的c(H+)=1×10-13mol·L-1的溶液中:Na+、K+、SO32-、CO32-
C.在c(H+)=11×10-13mol·L-1的溶液中:NH4+、Al3+、SO42-、NO3-
D.在pH=1的溶液中:K+、Fe2+、Cl-、NO3-
16.在一定体积pH = 12的Ba(OH)2溶液中,逐滴加入一定物质的量浓度的NaHSO4溶液,当
溶液中的Ba2+恰好完全沉淀时,溶液pH = 11。若反应后溶液的体积等于Ba(OH)2溶液与NaHSO4溶液的体积之和,则Ba(OH)2溶液与NaHSO4溶液的体积比是
A.1∶9 B.1∶1 C.1∶2 D.1∶4
15.一定温度下,氢氧化镁饱和溶液中存在如下关系:c(Mg2+)
• [c(OH-)] =Ksp,其中Ksp为常数,称为该温度下Mg(OH)2的溶度积常数。试推断氢氧化镁在下列物质中的溶解度由大到小的顺序是
=Ksp,其中Ksp为常数,称为该温度下Mg(OH)2的溶度积常数。试推断氢氧化镁在下列物质中的溶解度由大到小的顺序是
① 0.1mol·L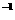 AlCl3溶液
② 0.1mol·L
AlCl3溶液
② 0.1mol·L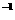 NH4Cl溶液
NH4Cl溶液
③ 0.1mol·L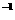 KCl溶液
④ 0.1mol·L
KCl溶液
④ 0.1mol·L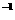 KAlO2溶液
KAlO2溶液
A.①④③② B.①②③④ C.③①④② D.④①③②
14.已知NaHSO4在水中的电离方程式为:NaHSO4 = Na+
+ H+ + SO 。某温度下, 向pH=6的蒸馏水中加入NaHSO4晶体,保持温度不变,测得溶液的pH为2。下列对该溶液的叙述中,不正确的是
。某温度下, 向pH=6的蒸馏水中加入NaHSO4晶体,保持温度不变,测得溶液的pH为2。下列对该溶液的叙述中,不正确的是
A.该温度高于25℃
B.由水电离出来的H+的浓度是1.0×10-10mol·L-1
C.NaHSO4晶体的加入抑制了水的电离
D.该温度下加入等体积pH为12的NaOH溶液可使该溶液恰好呈中性
13.如图所示,甲、乙之间的隔板K可以左右移动,甲中充入2molA和1molB,乙中充入2molC和1molHe,此时K停在0处。在一定条件下发生可逆反应:2A(g)+B(g) 2C(g),反应达到平衡后,恢复到反应发生前时的温度。下列有关说法不正确的是
2C(g),反应达到平衡后,恢复到反应发生前时的温度。下列有关说法不正确的是

A.根据隔板K滑动与否可判断左右两边的反应是否达到平衡
B.达到平衡后,隔板K最终停留在左侧刻度0~2之间
C.到达平衡时,甲容器中C的物质的量大于乙容器中C的物质的量
D.若平衡时K停留在左侧1处,则活塞仍停留在右侧6处
12.甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是
①CH3OH(g)+H2O(g)=CO2(g)+3H2(g); △H= + 49.0 kJ·mol-1
②CH3OH(g)+1/2O2(g)=CO2(g)+2H2(g); △H= -192.9 kJ·mol-1
下列说法正确的是
 A.CH3OH的燃烧热为192.9
kJ·mol-1
A.CH3OH的燃烧热为192.9
kJ·mol-1
B.反应①中的能量变化如右图所示
C.CH3OH转变成H2的过程一定要吸收能量
D.根据②推知反应:
CH3OH(l)+1/2O2(g)=CO2(g)+2H2(g)的△H>-192.9kJ·mol-1
11.甲醇燃料电池(DMFC)可用于笔记本电脑、汽车等,它一极通入甲醇;电解质是质子交换膜,它能传导氢离子(H+)。电池工作时,甲醇被氧化为二氧化碳和水,氧气在电极上的反应是:O2+4H++4e-=2H2O。下列叙述中不正确的是
A.电池的总反应是:2CH3OH+3O2=2CO2+4H2O
B.负极的反应为:CH3OH+H2O-6e-=CO2↑+6H+
C.电池工作时,电子从通入甲醇的一极流出,经外电路再从通入氧气的一极流入。
D.电池工作时,H+由正极移向负极
10.对可逆反应4NH3(g)+ 5O2(g) 4NO(g)+
6H2O(g),下列叙述正确的是
4NO(g)+
6H2O(g),下列叙述正确的是
A.达到化学平衡时,4υ正(O2)= 5υ逆(NO )
B.若单位时间内生成x mol NO的同时,消耗x mol NH3 ,则反应达到平衡状态
C.达到化学平衡时,若增加容器体积,则正反应速率减少,逆反应速率增大
D.化学反应速率关系是:2υ正(NH3)= 3υ正(H2O)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com