
题目列表(包括答案和解析)
3、一定温度下,对可逆反应A(g) +2B(g) ===3C(g)的下列叙述中,能说明反应已达到平衡的是( )
A.C生成的速率与C分解的速率相等; B.单位时间内消耗amolA,同时生成3amolC;C.容器内的压强不再变化; D.混合气体的物质的量不再变化。
2、一定条件下反应N2(g)+3H2(g) 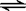 2NH3(g )在10L的密闭容器中进行,测得2min内,N2的物质的量由20mol减小到8mol,则2min内N2的反应速率为( )
2NH3(g )在10L的密闭容器中进行,测得2min内,N2的物质的量由20mol减小到8mol,则2min内N2的反应速率为( )
A.1.2mol/(L·min) B.1mol/(L·min)
C.0.6mol/(L·min) D.0.4mol/(L·min)
1、已知在1×105Pa、298K条件下,2mol氢气燃烧生成水放出484kJ热量,下列热化学方程式正确的是( )
A.H2O(g)==H2(g)+ O2 (g);
O2 (g); H= +242kJ·mol-1
H= +242kJ·mol-1
B.2H2(g)+O2(g)==2H2O(l); H= -484kJ·mol-1
H= -484kJ·mol-1
C.H2(g)+ O2(g)==H2O(g);
O2(g)==H2O(g); H= +242kJ·mol-1
H= +242kJ·mol-1
D.2H2(g)+O2(g)==2H2O(g); H= -484kJ·mol-1
H= -484kJ·mol-1
21.将0.3 mol NaCl固体与0.1 mol CuSO4•5H2O固体混合溶于水,配成1000ml混合液。然后取出200ml溶液,用石墨作电极,通电一段时间(不考虑水解)。试回答:
(1)电解过程分为 ▲ 个阶段,其中第二阶段发生的电解反应的离子方程式为
▲ 。
(2)长时间电解后,阳极上发生的电极反应式变为 ▲ 。
(3)若Cl-正好全部变为氯气逸出时,阴极上产生气体的体积为多少(标准状况下)?
▲
(4)若Cl-正好全部变为氯气逸出时,所得溶液的pH为多少(假设溶液体积不变)?
▲
20. (14分)某校化学兴趣小组学生为了探究乙酸、碳酸和苯酚的酸性强弱和证明乙酸溶液中存在电离平衡,进行了下述一些实验:
(14分)某校化学兴趣小组学生为了探究乙酸、碳酸和苯酚的酸性强弱和证明乙酸溶液中存在电离平衡,进行了下述一些实验:
(1)探究乙酸、碳酸和苯酚的酸性强弱关系
该校学生先组装了右图的实验装置(夹持仪器已略去)。
①某生检查装置A的气密性时,先关闭止水夹,从左管向U型管内加水,至左管液面高于右管液面,静置一段时间后,若U型管两侧液面差不发生变化,则气密性良好。你认为该学生的操作正确与否? ▲ (填“正确”或“错误”)
②装置A中反应产生的气体通入苯酚钠溶液中,实验现象为 ▲
反应的离子方程式为 ▲
③有学生认为②中的实验现象不足以证明碳酸的酸性比苯酚强,他的理由是
▲ 。改进该装置的方法是
▲ 。
(2)证明乙酸溶液中存在电离平衡
①现有pH=3的乙酸溶液、蒸馏水、pH试纸,选用适当的仪器和用品,简述证明乙酸溶液中存在电离平衡的实验方法 ▲
。
②根据以下信息,分析并回答相关问题:
弱酸弱碱盐溶于水中后,由于弱酸的阴离子和弱碱的阳离子都会发生水解,生成相应的酸或碱。溶液的酸碱性比较复杂,但主要还是由弱酸和弱碱的相对强弱决定。如氢氟酸比氨水强,则氟化铵溶液呈酸性;醋酸与氨水相当,则醋酸铵溶液显中性;氢氰酸比氨水弱,则氰化铵溶液则显碱性。
某学校学生的一次探究实验中发现:在pH约为3的醋酸溶液中加入少量醋酸钠晶体,待晶体溶解后发现溶液的pH增大。对上述现象甲、乙两组同学提出了不同的解释:
甲组同学观点:醋酸钠水解呈碱性,因而使溶液的pH增大;
乙组同学观点:醋酸钠电离出大量醋酸根离子,抑制了醋酸的电离,因而pH增大。
为了验证上述哪种观点正确,你认为可以向0.1 mol·L-1的醋酸溶液中加入少量的下列物质中的 ▲ (填写编号),然后测定溶液的pH即可。
A.醋酸钾固体 B.醋酸铵固体 C.氨水 D.氯化铵固体
(a)如果甲同学的观点正确,当加入你所选的物质后,溶液的pH ▲
(b)如果乙同学的观点正确,当加入你所选的物质后,溶液的pH ▲
19.(10分)某学生在实验室用化学方法来鉴别乙醇、乙醛、苯酚、乙酸4种无色溶液,其方法和操作步骤如下,试回答下列问题:
步骤1:向盛这4种溶液的试管A、B、C、D中分别加入试剂①,其中C试管中溶液变成蓝色,其他3支试管中无变化;
步骤2:分别对步骤1中的4支试管进行操作②,只有D试管中产生红色沉淀;
步骤3:另取同样编号的盛4种溶液的4支试管,分别加入试剂③,其中B试管有白色沉淀出现,其他3支试管无明显变化。
(1)试剂①是 ▲ ,操作②是 ▲ ,试剂③为 ▲ ;
(2)试管中分别盛的有机物是:
A ▲ ,B ▲ ,C ▲ ,D ▲ 。
18.(11分)在一定体积的密闭容器中,进行如下化学反应:
CO2(g)+H2(g) CO(g)+H2O(g)
CO(g)+H2O(g)
其化学平衡常数K和温度t的关系如下表:
|
t℃ |
700 |
800 |
830 |
1000 |
1200 |
|
K |
0.6 |
0.9 |
1.0 |
1.7 |
2.6 |
回答下列问题:
(1)该反应正向为ΔH ▲ 0;若该正向反应在某一温度压强下不自发进行,推测其熵变ΔS ▲ 0(选填“<”或“>”)。
(2)能判断该反应达到化学平衡状态的依据是 ▲ (多选扣分)。
(a)容器中压强不变 (b)混合气体中c(CO)不变
(c)v正(H2)=v逆(H2O) (d)c(CO2)=c(CO)
(3)某温度下,平衡浓度符合下式: 0.9·c(CO2)·c(H2)=c(CO)·c(H2O),试判断此时的温度为 ▲ ℃。其它条件不变,升高温度,原化学平衡向 ▲ 反应方向移动(填“正”或“逆”),容器内混合气体的密度 ▲ (填“增大”、“减小”或“不变”),气体平均相对分子质量 ▲ (填“增大”、“减小”或“不变”)。
(4)若在一密闭容器中,将一定量的CO与H2O混合加热到830℃下达到平衡。若反应开始时CO与H2O的浓度分别为0.200 mol·L–1和0.100 mol·L–1,平衡时CO的转化率
▲ 。
17.(12分)
(1)实验室在临时配制一些FeCl2的溶液时,常将氯化亚铁固体先溶于较浓的盐酸中,然后再用蒸馏水稀释到所需的浓度,是为了 ▲ 。
稀释后还需要加入一些铁粉,其目的是 ▲ ,相关反应的离子方程式为 ▲ 。
(2)氯化铁水溶液呈 ▲ 性 ,原因是(用离子方程式表示):
_____________________ ▲ _____________________________ 。
把FeCl3溶液蒸干,灼烧,最后得到的主要固体产物是 ▲ 。如果要从氯化铁溶液得到纯氯化铁固体,常采用的方法是 ▲ 。
16.(10分)已知1mol某链状酯A在酸性条件下完全水解,生成2mol B和1molC
|
|




 Δ
Δ
|
|


|


(1)写出结构简式:C ▲ 、D ▲
(2)已知B与NaOH溶液反应生成F,F与稀硫酸反应生成G,在催化剂条件下进行聚合,生成链状高分子H。
写出G→H的化学方程式 ▲ 。
(3)写出G的二种同分异构体的结构简式 ▲
(4)写出A与足量NaOH溶液共热的化学方程式 ▲ 。
15.(6分)火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态双氧水。当把0.4mol液态肼和0.8mol H2O2混合恰好完全反应,生成氮气和水蒸气,放出256 kJ的热量(相当于25℃、101 kPa下测得的热量)。
(1)反应的热化学方程式为 ▲ 。
(2)又已知16g液态肼与液态双氧水反应生成液态水时放出的热量是408 kJ。
则H2O(l)=H2O(g) 的ΔH= ▲ kJ•mol-1。
(3)此反应用于火箭推进,除释放大量热和快速产生大量气体外,还有一个很大的优点
是 ▲ 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com