
题目列表(包括答案和解析)
19. 已知反应CaCO3(s) CaO(s)+CO2(g)的有关数据如下:
CaO(s)+CO2(g)的有关数据如下:
ΔH=178.2kJ·mol-1, ΔS=169.6J·mol-1·K-1
则欲使碳酸钙分解为氧化钙和二氧化碳的反应自发进行,所需的温度不应该低于(假设该反应的焓变和熵变不随温度变化而变化)
A. 800K B. 298K C. 1051K D. 1K
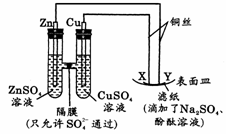
18. 如右图所示,下列叙述正确的是
A. Y为阴极,发生还原反应
B. X为正极,发生氧化反应
C. Y与滤纸接触处变红
D. X与滤纸接触处有氢气生成
17. 三氧化二镍(Ni2O3)可用于制造高能电池,其电解法制备过程如下:用NaOH调NiCl2溶液pH至7.5,加入适量硫酸钠后进行电解。电解过程中产生的Cl2在弱碱性条件下生成ClO-,ClO-把Ni2+氧化生成Ni2O3。以下说法正确的是
A. ClO-把Ni2+氧化生成Ni2O3时反应的离子方程式是:
ClO-+2Ni2++4OH-=Ni2O3+Cl-+2H2O
 B. 可用铁作阳极材料
B. 可用铁作阳极材料
C. 电解过程中阳极附近溶液的pH升高
D. 每生成1molNi2O3,外电路中转移1mol电子
16. 已知反应①H2(g)+ O2(g)===H2O(g) ΔH1
②N2(g)+O2(g)===NO2(g) ΔH2
③N2(g)+H2(g)===NH3(g) ΔH3
那么在相同温度下反应:4NH3(g)+7O2(g)===4NO2(g)+6H2O(g)的反应焓变为
A. 4ΔH3-6ΔH1-4ΔH2 B. 6ΔH1+4ΔH2-4ΔH3
C. ΔH1+ΔH2-ΔH3 D. ΔH3-ΔH1-ΔH2
15. 已知0.1mol·L-1的二元酸H2A溶液的pH=4,则下列说法中正确的是
A. 在Na2A、NaHA两溶液中,离子种类相同
B. 在溶质物质的量相等的Na2A、NaHA两溶液中,阴离子总数相等
C. 在NaHA溶液中一定有c(Na+)+c(H+)=c(HA-)+c(OH-)+2c(A2-)
D. 在Na2A溶液中一定有c(Na+)>c(A2-)>c(H+)>c(OH-)
14. 将0.2mol·L-1HCN溶液和pH=13的NaOH溶液等体积混合后,溶液显碱性,下列关系式中正确的是
A. c(Na+)>c(CN-) B. c(HCN)<c(CN-)
C. c(HCN)=c(OH-)+c(CN-) D. c(HCN)+c(CN-)=0.1mol·L-1
13. 室温时,下列混合溶液的pH一定小于7的是
A. pH=3的盐酸和pH=11的氨水等体积混合
B. pH=3的盐酸和pH=11的氢氧化钡溶液等体积混合
C. pH=3的醋酸和pH=11的氢氧化钡溶液等体积混合
D. pH=3的硫酸和pH=11的氨水等体积混合
12.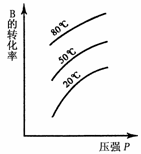 可逆反应A(s)+B
可逆反应A(s)+B C达到平衡后,
C达到平衡后,
B的转化率与压强、温度的关系如右图所示。
下列说法正确的是
A. B是固体,C是固体,正反应是吸热反应
B.B是气体,C是固体,正反应是吸热反应
C.B是气体,C是固体,正反应是放热反应
D.B、C都是气体,正反应是放热反应
11. 在一定温度下的密闭容器中,可逆反应:N2(g)+3H2(g) 2NH3(g)达到平衡状态。在保持温度不变的条件下,扩大容器的体积,下列说法中正确的是
2NH3(g)达到平衡状态。在保持温度不变的条件下,扩大容器的体积,下列说法中正确的是
A. V正减小,V逆增大 B. c(N2)、c(H2)增大,c(NH3)减小
C. N2的质量分数增大 D. 反应混合气体的平均摩尔质量将变小
10. 有一合金由X、Y、Z、W四种金属组成,若将合金放入盐酸中只有Z、Y能溶解;若将合金置于潮湿空气中,表面只出现Z的化合物;若将该合金做阳极,用X盐溶液作电解液,通电时四种金属都以离子形式进入溶液中,但在阴极上只析出X。这四种金属的活动性顺序是
A. Z>Y>W>X B. Y>Z>W>X
C. W>Z>Y>X D. X>Y>Z>W
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com