
题目列表(包括答案和解析)
2.下列叙述正确的是
A.铜可导电,所以铜是电解质
B.MgCl2在水溶液中和熔融状态下均可导电,它是电解质
C.HCl、H2SO4液态时都不导电,都是非电解质
D.能导电的单质一定是金属
1. 空气是人类生存所必需的重要资源。为改善空气质量而启动的“蓝天工程”得到了全民的支持。下列措施不属于“蓝天工程”建设的是
A.推广使用燃煤脱硫技术,防治SO2污染
B.实施绿化工程,防治扬尘污染
C.研制开发燃料电池汽车,消除机动车尾气污染
D.加高工厂的烟囱,使烟尘和废气远离地表
27.(10分)我国化学家侯德榜(右图)改革国外的纯碱生产工艺,生产流程可简要表示如下:

(1) 上述生产纯碱的方法称 ,副产品的一种用途为 。
(2) 沉淀池中发生的化学反应方程式是 。
(3) 写出上述流程中X物质的分子式 。
(4) 使原料氯化钠的利用率从70%提高到90%以上,主要是设计了 (填上述流程中的编号)的循环。从沉淀池中取出沉淀的操作是 。
(5)为检验产品碳酸钠中是否含有氯化钠,可取少量试样溶于水后,再滴加 。
(6) 向母液中通氨气,加入细小食盐颗粒,冷却析出副产品,通氨气的作用有 。
(a) 增大NH4+的浓度,使NH4Cl更多地析出 (b) 使NaHCO3更多地析出
(c) 使NaHCO3转化为Na2CO3,提高析出的NH4Cl纯度
26.(10分)气体混合物中各组分所占比例常用该气体的分压表示,下图是SO2在水中溶解度与SO2分压关系图。

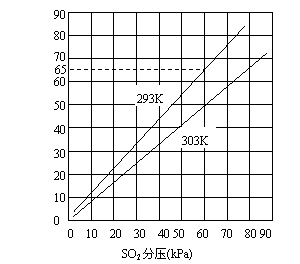

(1)上图反映SO2气体在水中溶解度大小与哪些因素有关?这些因素如何影响SO2气体的溶解度?
(2)长途运输鲜活水产品时可用充有富氧空气的橡皮袋为容器,解释充入富氧空气的作用。
 (3)上述图表中SO2的溶解度是以SO2计算的各种形体的总浓度,已知293K下SO2在水中存在如下反应与平衡:
(3)上述图表中SO2的溶解度是以SO2计算的各种形体的总浓度,已知293K下SO2在水中存在如下反应与平衡:
 ① SO2+xH2O
① SO2+xH2O SO2.xH2O
SO2.xH2O
② SO2.xH2O H++HSO3- +(x-1)H2O K1=1.44×10-2
 HSO3- H
++SO32- K2=1.02×10-7
HSO3- H
++SO32- K2=1.02×10-7
试计算SO2分压为60kPa时其水溶液的pH(保留两位小数)
(已知lg1.1=-0.96 lg0.12=-0.92 lg0.13=-0.88)
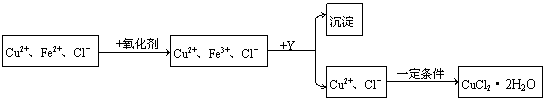
25、CuCl2溶液中含有少量杂质FeCl2,为制备纯净的晶体CuCl2·2H2O,拟定实验步骤如下:
 下面的数据可能对你解答本题有帮助。
下面的数据可能对你解答本题有帮助。
已知:溶度积:Ksp[Cu(OH)2]=2.2×10-20 Ksp[Fe(OH)2]= 8.0×10-16
Ksp[Fe(OH)3]= 4.0×10-38
(1)第一步将Fe2+氧化为Fe3+最适宜的氧化剂是( )
A.K2Cr2O7 B. NaClO C. H2O2 D. KMnO4
(2)加入Y的目的是为了调节溶液的酸度以促使Fe3+沉淀完全,Y可选用下列物质中的哪些?( )
A.NaOH B.NH3·H2O C.CuO D.Cu(OH)2
E .Cu2(OH)2CO3 F.Cu
(3)当溶液中c(Fe3+)<1.0×10-5mol/L时可以认为沉淀完全,计算此时溶液中的c(OH-)。此时所得沉淀中是否有Cu(OH)2(假定溶液中c(Cu2+)=0.2mol/L)?
(4)从Fe3+沉淀完全后的溶液中获得CuCl2·2H2O晶体时应控制的一定条件是
。
24、(8分)酸性锌锰干电池工作时的反应式为:Zn+2NH4Cl=ZnCl2+2NH3↑+H2↑
下面是一种废干电池的综合利用方案。

 (1)酸性锌锰干电池工作时正极的电极反应式为
。
(1)酸性锌锰干电池工作时正极的电极反应式为
。
(2)上述回收过程中得到的A主要成份是 ,操作①的名称是 。
(3)要将A分离成为单一成份的物质,可用实验室常见仪器组合成一套装置来实现,试补画出所缺仪器并标明仪器中所盛物质。


23、(6分)在以煤为主要原料的合成氨工业中,原料气氢气常用下述方法获得:
①C+H2O(g)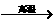 CO+H2;②CO+H2O(g)
CO+H2;②CO+H2O(g)
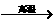 CO2+H2
CO2+H2
(1)从反应混合物中分离出H2的方法通常是以碱液洗气,根据该工业生产的实际分析,最好选用下列哪种溶液作为吸收剂? ,
A.氢氧化钠溶液 B.氨水 C.石灰水或石灰乳
该物质吸收CO2后的产物用途之一是 。
(2)已知500℃该反应的平衡常数为1.44,若CO和H2O(g)的起始浓度均为2.0mel/L,求上述反应达到平衡状态时CO的转化率。`
22、(6分)求25℃时以下溶液的pH
(1) pH=10和pH=12的两种NaOH溶液等体积混合后,pH= ____________
(2) pH=9的NaOH溶液稀释到原来的1000倍后,pH___________。
(3) pH=12的NaOH和pH=1的HCl等体积混合后,pH= ____________
21、(6分) 依据事实,写出下列反应的热化学方程式。
(1)在25℃、101kPa下,1g甲醇燃烧生成CO2和液态水时放热22.68kJ。则表示甲醇燃烧热的热化学方程式为___________________________________________
(2)若适量的N2和O2完全反应,每生成23克NO2需要吸收16.95kJ热量。____________________________________________________________________
(3) 已知拆开1molH-H键,1molN-H键,1molN≡N键分别需要的能量是436kJ、391kJ、946kJ,则N2与H2反应生成NH3的热化学方程式为__________________________
20、下列说法正确的是
A.增大压强,化学反应速率一定增大,平衡向正反应方向移动
B.放热反应一定是自发反应,吸热反应一定是不自发反应
C.向已达平衡状态的平衡体系中加入反应物一定会导致平衡正向移动
D.一般使用催化剂可以降低反应的活化能,增大活化分子百分数,增大化学反应速率
第Ⅱ卷(非选择题,共55分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com