
题目列表(包括答案和解析)
20.(12分)已知NO2和N2O4可以相互转化:2NO2(g) N2O4(g) △H<0。现将一定量NO2和N2O4的混合气体通入体积为2L的恒温密闭容器中,反应物浓度随时间变化关系如下图所示。
N2O4(g) △H<0。现将一定量NO2和N2O4的混合气体通入体积为2L的恒温密闭容器中,反应物浓度随时间变化关系如下图所示。
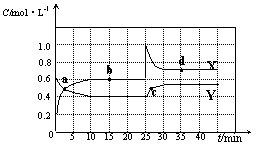 (1)图中共有两条曲线X和Y,其中表示NO2浓度随时间变化的曲线是 ;a、b、c、d四个点中,表示化学反应处于平衡状态的点是 。
(1)图中共有两条曲线X和Y,其中表示NO2浓度随时间变化的曲线是 ;a、b、c、d四个点中,表示化学反应处于平衡状态的点是 。
(2)①前10min内用NO2表示的化学反应速率v(NO2)= mol·L-1·min-1。
 ②反应2NO2(g) N2O4(g)在b点的平衡常数K(b)=
。
②反应2NO2(g) N2O4(g)在b点的平衡常数K(b)=
。
 ③反应2NO2(g) N2O4(g)在d点的平衡常数K(d)与b点的平衡常数K(b)的关系:
③反应2NO2(g) N2O4(g)在d点的平衡常数K(d)与b点的平衡常数K(b)的关系:
K(d) K(b)(填“>”、“=”或“<”)。
(3)①据图分析,在25min时采取的措施是 (填序号)。
A.加入催化剂 B.缩小容器体积 C.加入一定量的NO2 D.加入一定量的N2O4
②若在35min时,保持温度不变,快速缩小容器的体积至1L,气体的颜色变化过程是 。
19.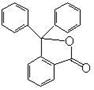 (7分)据测定指示剂酚酞的结构简式如右图所示,则:
(7分)据测定指示剂酚酞的结构简式如右图所示,则:
(1)酚酞的分子式为 。
(2)1mol酚酞与H2完全加成最多消耗H2 mol。
(3)1mol酚酞与NaOH溶液共热,最多可消耗NaOH mol,
化学方程式为 。
18.(6分)核磁共振谱(NMR)是测定有机物分子结构最有用的工具之一。在有机物分子中,不同位置的氢原子在1H核磁共振谱(1H-NMR)中给出的峰值(信号)是不同的,根据峰值(信号)可以确定有机物分子中氢原子的种类和数目。
(1)下列有机物分子中,在1H-NMR中只给出一种峰(信号)的是_____(填序号)。
A.C2H6 B.CH3COOH C.HCOOH D.CH3COCH3
(2)化学式为C3H6O2的混合物,在1H-NMR谱上观察氢原子给出的峰有两种情况,第一种情况峰的给出强度为3∶3;第二种情况峰的给出强度为3∶2∶1。由此可推断该混合物的组成可能是(写结构简式): 、 。
17.(8分)下表是几种常见弱酸的电离平衡常数Ka (25℃)。
|
酸 |
电离方程式 |
电离平衡常数Ka |
|
CH3COOH |
CH3COOH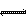 CH3COO-+H+ CH3COO-+H+ |
1.76×10-5 |
|
H2S |
H2S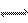 H++HS- H++HS-HS-  H++S2- H++S2- |
Ka1=9.1×10-8 Ka2=1.1×10-12 |
|
H3PO4 |
H3PO4 H++H2PO4- H++H2PO4-H2PO4-  H++HPO42- H++HPO42-HPO42-  H++PO43- H++PO43- |
Ka1=7.52×10-3 Ka2=6.23×10-8 Ka3=2.20×10-13 |
回答下列问题:
(1)一般情况下,当温度升高时,Ka (填“增大”、“减小”或“不变”)。
(2)同一温度下,各弱酸Ka的大小与酸性的相对强弱关系为
。
(3)若把CH3COOH、H2S、HS-、H3PO4、H2PO4-、HPO42-都看作是酸,其中酸性最强的是 ,最弱的是 。
(4)多元弱酸是分步电离的,每一步都有相应的电离平衡常数,对于同一种多元弱酸,Ka1、Ka2、Ka3在数值上相差甚大,如磷酸:Ka1∶Ka2∶Ka3≈1∶10-5∶10-10,造成这种差异的原因可能是 。
16.已知0.02 mol·L-1CH3COOH溶液和0.01 mol·L-1NaOH溶液以等体积混和后溶液呈酸性,则该混合液中微粒浓度关系正确的
A.c (CH3COO-)>c (Na+)
B.c (Na+) + c (H+) == c (OH-) +c (CH3COOH)+c (CH3COO-)
C.c (CH3COOH)>c (CH3COO-)
D.c (CH3COOH)+c (CH3COO-)=0.01 mol·L-1
第Ⅱ卷 (非选择题共56分)
15.乙酸乙酯的实验室和工业制法常采用如下反应:
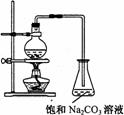
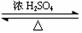 CH3COOH+C2H5OH
CH3COOC2H5+H2O
CH3COOH+C2H5OH
CH3COOC2H5+H2O
若用右图所示的装置来制备少量的乙酸乙酯,下列因素①乙醇挥发;②浓硫酸催化效果较差;③反应温度过高生成乙醚,能导致产率偏低的是
A.只有① B.只有①② C. 只有①③ D.①②③都可以
14.常温下,将2LpH=1的硫酸溶液平均分成两等份,一份加入适量水,另一份加入与该硫酸溶液物质的量浓度相同的氢氧化钠溶液,两者pH都升高了1,则加入水和氢氧化钠溶液的体积比为
A.5:1 B.6:1 C.10:1 D.11:1
13.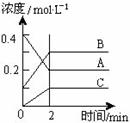 右图为800℃时A、B、C三种气体在密闭容器中反应时浓度的变化情况,据此分析不能得出的结论是
右图为800℃时A、B、C三种气体在密闭容器中反应时浓度的变化情况,据此分析不能得出的结论是
A.A是反应物,B、C是生成物
B.前2 min A的分解速率为0.1mol·L-1·min-1
C.达平衡后,若升高温度,平衡向正反应方向移动
D.达平衡后,若增大压强,平衡向逆反应方向移动
12.铜板上铁铆钉处的吸氧腐蚀原理如下图所示,下列有关说法错误的是
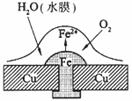 A.正极电极反应式为:2H++2e-=H2↑
A.正极电极反应式为:2H++2e-=H2↑
B.此过程中还涉及到反应:4Fe(OH)2+2H2O+O2=4Fe(OH)3
C.此过程中Cu并不被腐蚀
D.此过程中电子从Fe移向Cu
11.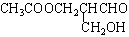 在有机物分子中,若某个碳原子连接着四个不同的原子或原子团,这种碳原子称为“手性碳原子”,凡有手性碳原子的物质一定具有光学属性。右图有机物发生下列反应后的生成物无光学活性的是
在有机物分子中,若某个碳原子连接着四个不同的原子或原子团,这种碳原子称为“手性碳原子”,凡有手性碳原子的物质一定具有光学属性。右图有机物发生下列反应后的生成物无光学活性的是
A.与甲酸发生酯化反应 B.与NaOH 水溶液共热
C.与银氨溶液作用 D.在催化剂存在下与氢气反应
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com