
题目列表(包括答案和解析)
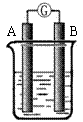
27.(8分)某研究性学习小组欲探究原电池的形成条件,按右图所示装置进行实验并得到下表实验结果:
|
实验 序号 |
A |
B |
烧杯中的液体 |
 灵敏电流计指 灵敏电流计指针是否偏转 |
|
1 |
Zn |
Zn |
乙醇 |
无 |
|
2 |
Zn |
Cu |
稀硫酸 |
有 |
|
3 |
Zn |
Zn |
稀硫酸 |
无 |
|
4 |
Zn |
Cu |
苯 |
无 |
|
5 |
Cu |
C |
氯化钠溶液 |
有 |
|
6 |
Mg |
Al |
氢氧化钠溶液 |
有 |
分析上述数据,回答下列问题:
(1)实验2中电流由 极流向 极(填“A”或“B”)
(2)实验6中电子由B极 流向A极 ,表明负极是 电极(填“镁”或“铝”)
(3)实验5 表明
A.铜在潮湿空气中不会被腐蚀 B.铜的腐蚀是自发进行的
(4)分析上表有关信息,下列说法不正确的是
A.相对活泼的金属一定做负极
B.失去电子的电极是负极
C.烧杯中的液体,必须是电解质溶液
D.浸入同一电解质溶液中的两个电极,是活泼性不同的二种金属(或其中一种非金属)
26.(8分)把煤作为燃料可通过下列两种途径:
途径I: C(s)+O2(g) === CO2(g)
途径II:先制水煤气: C(s) + H2O(g) === CO(g) + H2(g)
燃烧水煤气:2 CO(g) + O2(g) === 2CO2(g);
2H2(g)+O2(g) ===2H2O(g)
已知:①C(s)+O2(g)===CO2(g);△H1=-393.5 kJ·mol-1
②H2(g)+ O2(g)=H2O(g);△H2=-241.8kJ·mol-1
O2(g)=H2O(g);△H2=-241.8kJ·mol-1
③CO(g)+  O2 (g)
=CO2(g);△H3=-283.0kJ·mol-1
O2 (g)
=CO2(g);△H3=-283.0kJ·mol-1
请回答下列问题:
(1)C的标准燃烧热是 kJ·mol-1
(2)根据盖斯定律写出煤和气态水生成水煤气的热化学方程式:
(3)在制水煤气反应里,反应物具有的总能量________(填“>”、“<”或“=”)生成物所具有的总能量
(4)根据两种途径,下列说法错误的是
A.途径II制水煤气时增加能耗,故途径II的做法不可取
B.与途径I相比,途径II可以减少对环境的污染
C.与途径I相比,途径II可以提高煤的燃烧效率
D.将煤转化为水煤气后,便于通过管道进行运输
25. (8分)一定温度下,在容积为1L的密闭容器内放入2mol N2O4和8 mol NO2,发生如下反应:2NO2(红棕色)
(8分)一定温度下,在容积为1L的密闭容器内放入2mol N2O4和8 mol NO2,发生如下反应:2NO2(红棕色) N2O4(无色)(△H<0),反应中NO2、N2O4的物质的量随反应时间变化的曲线如下图,按下列要求作答:
N2O4(无色)(△H<0),反应中NO2、N2O4的物质的量随反应时间变化的曲线如下图,按下列要求作答:
(1)在该温度下,反应的化学平衡常数表达式为:
(2)若t1=10s,t2=20s,计算从t1至t2时以N2O4表示的反应速率: mol·L-1·s-1
(3)图中t1、t2、t3哪一个时刻表示反应已经达到平衡?答: (4)t1时,正反应速率 (填“>”、“<”或“=”)逆反应速率
(5)维持容器的温度不变,若缩小容器的体积,则平衡向 移动 (填“正反应方向”、“逆反应方向”或“不移动”)
(6)维持容器的体积不变,升高温度,达到新平衡时体系的颜色 (填“变深”、“变浅”或“不变”)
24.(10分)在常温下,下列五种溶液:
①0.1mol/L NH4Cl ②0.1mol/L CH3COONH4 ③ 0.1mol/L NH4HSO4
④0.1mol/L NH3·H2O和0.1mol/L NH4Cl混合液 ⑤0.1mol/L NH3·H2O
请根据要求填写下列空白:
(1)溶液①呈 性(填“酸”、“碱”或“中”),其原因是
(用离子方程式表示)
(2)在上述五种溶液中,pH最小的是 ;c(NH4+)最小的是 ﹝填序号﹞
(3)比较溶液②、③中c(NH4+)的大小关系是② ③ ﹝填“>”、“<”或“=”)
(4)在溶液④中, 离子的浓度为0.1mol/L;NH3·H2O和 离子的物质的量浓度之和为0.2 mol/L
(5)常温下,测得溶液②的pH=7,则说明CH3COO-的水解程度________(填“>”、“<”或“=”) NH4+ 的水解程度,CH3COO-与NH4+浓度的大小关系是:c(CH3COO-) c(NH4+)(填“>”、“<”或“=”)
23.(10分)化学能和电能的相互转化,是能量转化的重要方式之一,右图两个实验装置是实现化学能和电能相互转化的装置。
(1)把化学能转化为电能的装置是 (填“甲”或“乙”)
(2)④电极上的电极反应式为
(3)①电极上的电极反应式为
检验该电极反应产物的方法是
(4)甲、乙两装置电极附近的溶液首先变红的电极分别是 、 (填序号)
(5)写出装置甲的反应总方程式
2008.1
化 学(化学反应原理)
(试卷满分:100分;考试时间:90分钟)
登分表:
选择题答题表:
第Ⅱ卷(非选择题,共56分)
22.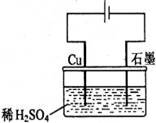 某同学按右图所示的装置进行电解实验。下列说法正确的是
A.电解过程中,铜电极上有H2产生
B.电解过程中,铜电极不断溶解
C.电解过程中,石墨电极上始终有铜析出
D.整个电解过程中,H+的浓度不断增大
某同学按右图所示的装置进行电解实验。下列说法正确的是
A.电解过程中,铜电极上有H2产生
B.电解过程中,铜电极不断溶解
C.电解过程中,石墨电极上始终有铜析出
D.整个电解过程中,H+的浓度不断增大
泉州市2007-2008学年度高二年上学期普通高中新课程模块水平测试
21.氯化铜溶液中含有少量氯化铁杂质,若要制得纯净的氯化铜,向溶液中加入下列试剂,不能达到目的的是 A. NaOH B. CuO C.Cu(OH)2 D.Cu(OH)2CO3
20.常温下,纯水中存在电离平衡:H2O H++OH-。欲使水的电离平衡向正方向移动,并使c(H+)增大,应加入的物质是
H++OH-。欲使水的电离平衡向正方向移动,并使c(H+)增大,应加入的物质是
A.H2SO4 B.AlCl3 C.NaHCO3 D.NaOH
19.下列说法不正确的是
A.钢铁发生电化学腐蚀时,负极发生的反应是2H2O+O2+4e-= 4 OH- B.在空气中,金属铝表面能迅速被氧化形成保护膜,因此铝不容易被腐蚀 C.铸铁输油管道应埋在干燥致密不透气的土壤中 D.白铁(镀Zn铁)表面有划损时,也能阻止铁被氧化
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com