
题目列表(包括答案和解析)
1、已知反应X+Y= M+N为放热反应,,对该反应的下列说法中正确的
A、X的能量一定高于M
B、Y的能量一定高于N
C、X和Y的总能量一定高于M和N的总能量
D、因该反应为放热反应,故不必加热就可发生
19.2g X y
解得x=0.6mol(2分)
y=0.3mol(1分) VSO2=0.3mol×22.4L/mol=67.2L(1分)
(2)反应后剩余硫酸的物质的量=0.2L×6mol/L=1.2mol (1分)
反应前硫酸的总物质的量=0.6mol+1.2mol=1.8mol (1分)
则C(H2SO4)=1.8nol/0.1L=18mol/L (2分)
答;略
28.1)设与19.2gCu完全反应需硫酸的物质的量为xmol,
生成SO2的物质的量为ymol
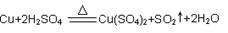
64g 2mol 1mol
27.
(1)①②⑤⑥⑦(4分,全对得4分;错选一个、漏选一个扣1分,扣完为止;{6}选与不选均可)
(2)10.0(1分); 两 偏小(1分)
(3)玻璃棒在溶解固体时,起搅拌、加速溶解作用(1分);
玻璃棒在转移溶液时,起引流作用(1分)
(4)250mL(2分)
26.(除(1)小题1分外,其余各小题每题2分,共7分)
(1)Al2O3 (2)Al2O3+2OH-=2AlO2-+H2O
(3)Al3++3NH3·H2O = Al(OH)3↓+3NH4+ (4)AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-
24. B ①过滤 ②洗气 ③蒸馏 ④加热分解
25(1)能
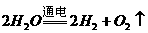
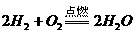 ;
;
(2)来源广;②生成物是水,无污染;③燃烧时放出的热量多等。
(1)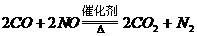 ;还原。
;还原。
28.把19.2g铜完全溶解于100mL一定浓度的浓硫酸中,待加热反应后的溶液冷却,再加水稀释到200mL,此时溶液中c(H2SO4)为6mol/L,试求:
(1)反应收集的二氧化硫气体在标准状况下的体积;
(2)原浓硫酸的物质的量浓度。
答案:1、A、2、C、3、B、4、B、5、D、6、C、7、B、8、C、9、C、10A、11、A、12、D、13、B、14、D、15、C、16、C、17、B、18、D、19、C、20、A、21、B、22、C、23、D
27.某同学要配制1.0mol·L-1的NaOH溶液,提供的仪器有①容量瓶(250mL) ②玻璃棒 ③分析天平(或电子天平) ④药匙 ⑤胶头滴管 ⑥量筒 ⑦烧杯 ⑧漏斗
请回答下列问题:
⑴上述仪器中配制溶液时所需的玻璃仪器有 (填序号);
⑵由题意可知,你应该称取固体NaOH g,在称量过程中需要称量 次;
下列情况会如何导致溶液浓度变化 (填“偏大”、“偏小”或“相等”);
A.容量瓶使用前经蒸馏水清洗后没有干燥 ( )
B.配制过程中,未用蒸馏水洗涤烧杯和玻璃棒 ( )
C.俯视确定凹液面与刻度线相切 ( )
D.如果由于称量的时间过长 ( )
⑶在配制的整个过程中,如果使用玻璃棒,试说明其用途
;
⑷用上述浓度的NaOH溶液500mL,与1.0mol·L-1的硫酸恰好完全反应,则需硫酸的体积是 。
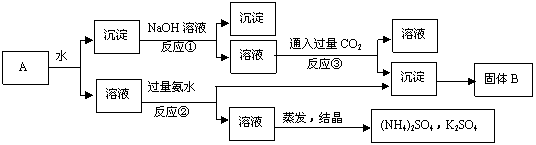
26.某混物A,含有KAl(SO4)2、Al2O3和Fe2O3,在一定条件下可实现下图所示的物质之间的变化如上图:
据此判断:
(1)固体B的所含物质的化学式 ;(2)反应①的离子方程式 ;
(3)反应②的离子方程式 ;(4)反应③的离子方程式 ;
25. ⑴新能源的开发利用是当今全球的一个重大研究课题,发展氢能源有着广阔的前景,有研究人员提出了“利用太阳能,以水为原料,大量生产氢气,并用作各种机械的动力燃料”这一设想。试回答下列问题:
①你认为这一设想能否实现? 若认为能,请写出有关的两个化学方程式___________ ; .
②氢气作为燃料与现在广泛使用的化石燃料相比有什么优点?(要求答出两点)
a__________ _;b________ ___。
⑵为了降低汽车尾气对空气的污染,可用纳米级的某种氧化物作催化剂,使尾气中的CO与氮氧化物(NO)反应,转化为空气中含有的两种气体(其中一种为单质),该反
应的化学方程式为__________ _,其中NO发生了___________(填“氧
化”或“还原”)反应。

湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com