
题目列表(包括答案和解析)
21.(14分)回答下面用0.1000mol/L NaOH溶液滴定待测硫酸溶液的问题:
(1)盛放待测硫酸的锥形瓶下方垫一张白张的作用是 。
(2)用酚酞作指示剂,滴定到达终点时,溶液颜色变化是 。
(3)滴定时,左手 ,右手 ,眼睛注视 。
(4)有下列操作:
①碱式滴定管用蒸馏水洗净后,未经标准液润洗就注入标准NaOH溶液
②用酸式滴定管取用待测液前,尖嘴部位有气泡,取用过程中气泡消失
③滴定前,读碱式滴定管内碱液体积时仰视液面,滴定后读碱液体积时,俯视液面
④锥形瓶未用待液润洗
哪些操作会使硫酸浓度的测定值偏低? 。
哪些操作会使硫酸浓度的测定值偏高? 。
 (5)若滴定到终点时不慎多滴了一滴NaOH溶液(假定20滴为1mL),此时溶液体积为50mL,则此时溶液的pH为
。
(5)若滴定到终点时不慎多滴了一滴NaOH溶液(假定20滴为1mL),此时溶液体积为50mL,则此时溶液的pH为
。
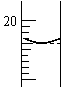
(6)若实验取待测液体积为20.00mL,碱式滴定管初读数为0.00mL,
达到终点时读数如图所示。则待测液物质的量浓度为 。
(1)便于观察溶液的颜色变化,减小滴下误差。
(2)由无色变为浅红色,并在半分钟内不褪色。
(3)控制滴定管(玻璃球);摇动锥形瓶;溶液颜色变化
(4)②③;① (5)10 (6)0.5100mol/L
20.(7分)泡沫灭火器的原理是将明矾溶液和NaHCO3溶液分别盛装在两个容器中(铁质容器和玻璃容器),使用时将两溶液混合,即可产生大量CO2气体和Al(OH)3沉淀。
(1)明矾溶液应盛装在 容器中,原因是 。
(2)明矾与NaHCO3溶液反应的离子方程式 。
(3)能否将NaHCO3溶液换成等体积等物质的量浓度的Na2CO3溶液: ,原因是 。
(1)玻璃容器; Al3+水解溶液成酸性,腐蚀铁质容器。
(2)Al3+ + 3HCO3- = Al(OH)3↓+ 3CO2↑
(3)不能; 等物质的量的CO32-消耗H+是HCO3-的两倍,明矾水解提供的H+不能使Na2CO3完全反应生成CO2,影响灭火效果。(要点:①等物质的量的Na2CO3耗H+比NaHCO3多,②Na2CO3不能完全反应生成CO2。)
19.(6分)(1)铝片和足量的氢氧化钠溶液反应,若铝片上连接镁条并一起浸入氢氧化钠溶液,化学反应速率 (填“增大”、“减小”、“不变”),产生H2的体积(相同状况) (填“增大”、“减小”、“不变”),负极上的电极反应方程式为 。
增大 不变 Al - 3e- = Al3+
 (2)右图为将Zn投入一定浓度一定体积的H2SO4中,解释
(2)右图为将Zn投入一定浓度一定体积的H2SO4中,解释
t1时刻前速率变化的原因是 ,t1时刻后速率变化的原因是 。(纵坐标为H2的生成速率)
开始时反应放热,溶液温度升高,反应速率加快;
到一定时间时盐酸浓度减小,反应速率减慢。
18.(9分)在保存FeCl2 溶液时,通常加入少量的铁粉或铁钉,目的是 。为了检验FeCl2溶液是否变质,可加入 ,现象是 。向FeCl2溶液中滴入NaOH溶液,现象是 ,有关化学方程式为 。
防止Fe2+被氧化 KSCN溶液 溶液变红色
产生白色沉淀,迅速变为灰绿色,最后变红褐色。
FeCl2 + 2NaOH = Fe(OH)2↓+ 2NaCl 4NaOH + O2 + 2H2O = 4Fe(OH)3
17.(4分)在金、钠、铁、铝几种金属中,在空气中最稳定的是 ;最活泼的是 ;既能与酸反应又能与碱反应的是 ;适合于用热还原法冶炼的是 。
Au;Na;Al;Fe
16.下列实验操作和实验数据记录都正确的是( D )
A.用垫有滤纸的托盘直接称取NaOH固体,质量为10.2g
B.用碱式滴定管准确移取KMnO4溶液,体积为21.50mL
C.用湿润的pH试纸测稀盐酸溶液的pH值,pH=3.5
D.用10mL量筒粗略量取NaCl溶液,体积为9.2mL
15.一定量的盐酸跟足量的镁粉反应时,为了减缓化学反应速率,且不影响生成的H2的总量,可向盐酸中加入适量的( BC )
A.NaOH(固) B.H2O C.CH3COONa D.Zn粉
14.在一定温度下,可逆反应N2(g)+3H2(g)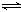 2NH3(g)达到平衡的标志是( B
)
2NH3(g)达到平衡的标志是( B
)
A.生成1mol N2同时生成3mol H2
B.N2、H2、NH3的体积分数不再变化
C.N2、H2、NH3的物质的量浓度相等
D.N2、H2、NH3的分子数之比为1∶3∶2
13.25℃时,1体积pH=2.5的盐酸与10体积NaOH溶液恰好完全反应,该NaOH溶液pH等于( D )
A.12.5 B.11.5 C.11 D.10.5
12.将等物质的量的Mg和Al混合均匀,分成四等份,分别加到下列四种过量的溶液中,充分反应后,放出H2最多的是( A )
A.3mol/LHCl溶液 B.4mol/LHNO3溶液
C.8mol/LNaOH溶液 D.18mol/LH2SO4溶液
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com