
题目列表(包括答案和解析)
4、下列各分子中所有原子都符合8电子结构的是 A.BeCl2 B.PCl3 C.PCl5 D.H2O
3、碳化硅(SiC)的一种晶体具有类似金刚石的结构,其中碳原子和硅原子的位置是交替的.在下列三种晶体①金刚石、②晶体硅、③碳化硅中,它们的熔点从高到低的顺序是
(A)①③② (B)②③① (C)③①② (D)②①③
2、下列关于元素周期表和元素周期律的说法错误的是
A.Li、Na、K元素的原子核外电子层数随着核电荷数的增加而增多
B.第二周期元素从Li到F,非金属性逐渐增强
C.因为Al比Mg失去电子数多,所以Al比Mg的还原性强
D.O与S为同主族元素,且O比S的非金属性强
1、32S与33S互为同位素,下列说法正确的是
A.32S与33S原子的最外层电子数均为2
B.32S与33S具有相同的中子数
C.32S与33S具有不同的电子数
D.32S与33S具有相同的质子数
24.(10分)乙烯和乙烷混合气体共a mol,与b mol的氧气共存于一密闭容器中,点燃后充分反应,乙烯和乙烷全部消耗完,得到CO和CO2的混合气体和45 g水。试求:
(1)当a=1时,乙烯和乙烷的物质的量之比n(C2H4):n(C2H6)=_________。
(2)当a=1时,且反应后CO和CO2混合气体的物质的量为反应前氧气的2/3时,则b=______,得到的CO和CO2的物质的之比n(CO):n(CO2)=__________________。
(3)a的取值范围是____________________________。
(4)b的取值范围是____________________________。
23.(10分)恒温下,将amolN2与bmolH2的混合气体通入一个固定容积的密闭容器中,发生如下反应:N2(g) + 3H2
(g) 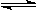 2NH3(g)
2NH3(g)
(1)若反应达平衡前某时刻t时,n(N2)=13mol,n (NH3)=6mol,则a=________mol。
(2)反应达平衡时,若混合气体的体积为716.8L(已换算为标况下),其中NH3的含量(体积分数)为25%。则平衡时NH3的物质的量为__________________。
(3)原混合气体与平衡混合气体的总物质的量之比(写出最简整数比,下同) n(起始):n(平衡)= ;原混合气体中,a:b=
(4)达到平衡时,N2和H2的转化率之比, (N2) :
(N2) :  (H2) =
(H2) =
22.(9分)(1)(3分)高铁电池是一种新型可充电电池,与普通电池相比,该电池能长时间保持稳定的放电电压。高铁电池的总反应为:
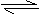 3Zn+2K2FeO4+8H2O 3Zn(OH)2+2Fe(OH)3+4KOH,请写出:
3Zn+2K2FeO4+8H2O 3Zn(OH)2+2Fe(OH)3+4KOH,请写出:
①放电时负极的反应式 。
②放电时正极附近溶液的碱性 (填增强、减弱或不变)
(2)(6分)剪约6cm长,2cm宽的铜片和铝片各一片,分别用接线柱平行地固定在一块塑料板上(间隔2cm),将铜片与铝片分别和电流表的“+”、“-”端相连结,电流表指针调到中间位置,取50mL两只小烧杯,在一只烧杯中注入40mL浓HNO3,另一只烧杯中注入40mL稀硫酸,试回答下列问题:
①两电极同时插入稀H2SO4中,原电池的负极为 (填“铝”或“铜”)极,铝片上的电极反应式为 。
②两电极同时插入浓HNO3中,原电池的负极为 (填“铝”或“铜”)极,铝片上的电极反应式为 。
21.(8分)常温下有浓度均为0.5mol·L-1的四种溶液:①碳酸钠溶液 ②碳酸氢钠溶液 ③盐酸 ④氨水。请根据题目要求回答下列问题:
(1)(2分)上述溶液中,可发生水解反应的是 (填序号,下同),在发生水解反应的溶液中pH最大的是 。
(2)(1分)上述溶液中,既能与氢氧化钠溶液反应,又能与硫酸溶液反应的是 。
(3)(1分)取适量溶液④,加入少量氯化铵固体,此时溶液中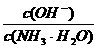 的值 (填“增大”或“减小”或“不变”)
的值 (填“增大”或“减小”或“不变”)
(4)(2分)将等体积的③和④的溶液混合后,所得溶液中离子浓度由大到小的顺序是
。
(5)(2分)取10mL溶液③,加水稀释到500mL,则该溶液中由水电离出的
c(H+)= mol·L-1
20.下列中学化学中常见物质的转化关系图中,反应条件及部分反应物和产物未全部注明,已知A、D为金属单质,其他为化合物。试推断:

(1)(3分)写出物质的化学式:A:_______ C:________ I:________
(2)(4分)写出下列反应的方程式:
C→F的离子方程式
H→I的化学方程式
19.I.(2分)下列实验操作或对实验事实的叙述正确的是___________(填序号)
①用碱式滴定管量取20.00 mL 0.10mol/L KMnO4溶液;
②用托盘天平称取10.50 g干燥的NaCl固体;
③各放一张质量相同的滤纸于天平的两托盘上,将NaOH固体放在左盘纸上称量;
④配制Al2(SO4)3溶液时,加入少量的稀硫酸;
⑤将未经湿润的pH试纸浸到某溶液中,过一会取出与标准比色卡比较测得该溶液的pH;
⑥中和滴定中,锥形瓶用蒸馏水洗净后可直接往其中注入一定量的待测溶液。
 II.(10分)下图所示装置中,a是盛有标况下224 mL空气 (氧气占五分之一)和10 mL 1.2 mol/L硝酸的烧瓶,b是未充气(实验开始前内部没有气体)装有0.384 g铜粉的气球,c是夹紧了的弹簧夹,d中盛有足量的过氧化钠,e是充有二氧化碳的注射器。整套装置经过气密性检查已合格。
II.(10分)下图所示装置中,a是盛有标况下224 mL空气 (氧气占五分之一)和10 mL 1.2 mol/L硝酸的烧瓶,b是未充气(实验开始前内部没有气体)装有0.384 g铜粉的气球,c是夹紧了的弹簧夹,d中盛有足量的过氧化钠,e是充有二氧化碳的注射器。整套装置经过气密性检查已合格。
(1)将气球中的铜粉小心倒入烧瓶中,充分反 应后发现铜粉有剩余(设产生的气体不溶解于溶液中),则可观察到的现象是_________。
(2)欲提高铜与硝酸反应的速率可采用多种不同的措施,若用加入化学试剂法,下列试剂中可以使用的是(填代号)________________________。
A.蒸馏水 B.无水醋酸钠 C.石墨 D.硝酸银(少量)
(3)将烧瓶充分振荡,所观察到的现象是____________________________;有关反应的化学方程式__________________________________________________。
(4)打开弹簧夹c,将二氧化碳推入干燥管内,使反应充分进行。将烧瓶中反应的全过程用一个总的化学方程式表示:_______________________________________。
(5)欲使所有的铜粉都溶解,至少需要推入二氧化碳_________mL(设推入的二氧化碳全部反应)。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com