
题目列表(包括答案和解析)
14、根据电子排布的特点,Fe在周期表属于
A.s区 B.p区 C.d 区 D.ds区
13、在下列各组中,只要混合物的物质的量总和不变,按任意比混合,
完全燃烧所消耗的O2的总量不变的是
A.甲烷、甲醇、甲醛
B. 甲醇、乙醇、丙醇
C.乙炔、苯、乙烯基乙炔(CH2=CH-C≡CH)
D. 乙醇、乙烯、丙稀酸(CH2=CH-COOH)
12、下列说法正确的是
A.Xm+和Yn-与氖的电子层结构相同,原子半径前者大于后者。
B.NaF和MgF2中阳离子与阴离子半径之比,前者小于后者。
C.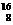 O和
O和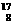 O原子的核外电子数,前者大于后者。
O原子的核外电子数,前者大于后者。
D.PH3和H2S的稳定性,前者大于后者。
11、NH4+离子的空间构型是
A. 平面正方形 B. 三角锥形 C.正四面体 D. 八面体
10、具有下列电子排布式的原子中,半径最大的是
A.ls22s22p63s23p3 B. 1s22s22p3 C.1s22s22p5 D. 1s22s22p63s23p4
9、下列物质:①干冰,②石英,③白磷,④氯仿(CHCl3),⑤过氧化钠。
其中含极性键的非极性分子是
A.②③⑤ B.②③ C.① D.①③④
8、x、y为两元素的原子,x的阴离子与y的阳离子的电子层结构相同,
由此可知
A. x的原子半径大于y的原子半径
B. x的第一电离能小于y 的第一电离能
C. x的金属性大于y的金属性
D. x的电负性大于y的电负性
7、将用于2008年北京奥运会的国家游泳中心(水立方)的建筑采用了膜材料ETFE,该材料为四氟乙烯与乙烯的共聚物,四氟乙烯也可与六氟丙烯共聚成全氟乙丙烯。下列说法错误的是
A.ETFE分子中可能存在“-CH2-CH2-CF2-CF2-”的连接方式
B.合成ETFE及合成聚全氟乙丙烯的反应均为加聚反应
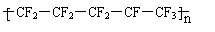 C.聚全氟乙丙烯分子的结构简式可能为
C.聚全氟乙丙烯分子的结构简式可能为
D.四氟乙烯中既含有极性键又含有非极性键
6、用价层电子对互斥理论预测H2S和BF3的立体结构,两个结论都正确的是
A.直线形;三角锥形 B. V形;三角锥形 C.直线形;平面三角形 D. V形;平面三角形
5、下列物质中,即含有离子键,又含有非极性共价键的是
A.Na2O2 B.NaOH C.Na2O D.MgCl2
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com