
题目列表(包括答案和解析)
24.将a g CuO和Fe2O3的混合物分成两等份,向其中一份中加入b mL c mol/L的稀硫酸正好完全反应;另一份在加热的条件下用H2还原,反应完全时用去H2 d L(折算成标准状况)。则d等于
 A.22.4bc×10-3
B.44.8bc×10-3
A.22.4bc×10-3
B.44.8bc×10-3
C.22.4(3a-4bc×10-3) D.22.4(3a-4bc)×10-3
23.有一氧化铁样品,用5mol/L的盐酸140mL恰好完全溶解,所得溶液还能吸收标准状况下0.56L氯气,亚铁离子全部转变为铁离子,则该氧化物可能的化学式为
A.Fe 2O 3 B. Fe 3O 4 C.Fe 4 O5 D.Fe 5O 7
21.铊 (Tl) 是某超导材料的组成元素之一,与铝同族,位于第六周期。Tl3+与Ag在酸性介质中发生反应:Tl3++2Ag=Tl++2Ag+ 。下列推断正确的是
A.Tl+的最外层有一个电子 B.Tl3+ 的氧化性比Al3+ 弱
C.Tl能形成+3价和+1价的化合物 D.Tl+ 的还原性比Ag强
[ ] 22.2006年,科学家们发明了一种能够给电子设备提供动力的生物燃料电池。该电池包括两个涂覆着酶的电极,它们处于充满空气和少量氢气的玻璃槽中。由于气体可以混合从而省去了昂贵的燃料隔离膜,其工作原理如图所示。下列说法正确的是
22.2006年,科学家们发明了一种能够给电子设备提供动力的生物燃料电池。该电池包括两个涂覆着酶的电极,它们处于充满空气和少量氢气的玻璃槽中。由于气体可以混合从而省去了昂贵的燃料隔离膜,其工作原理如图所示。下列说法正确的是
A.左边为该电池的负极 B.该电池可在高温环境下使用
C.该电池负极反应为:H2-2e-=2H+ D.该电池正极反应为O2+4e-=2O2-
20.常温下,将V1 mL、c1 mol·L-1的氨水滴加到V2 mL、c2 mol·L-1的盐酸中,下列结论正确的是
A.若混合溶液的pH=7,则c1·V1>c2·V2 B.若V1=V2,c1=c2,则混合液中c(NH+4)=c(Cl-)
C.若混合液的pH=7,则混合液中c(NH4+)>c(Cl-) D.若V1=V2,且混合液的pH<7,则一定有c1<c2
19.把一定量某碱金属与2.7g铝的混合物放入足量水中,金属全部溶解,收集到标准状况下的气体5.6L,向所得溶液中通入过量二氧化碳,过滤,把滤液低温减压蒸干得固体20g,则此碱金属的相对原子质量为
A 7 B 23 C 39 D 85
18.Mg、Al、Fe三种金属的混合物与足量的稀硫酸反应,生成2.80L H2(标准状况),则三种金属的物质的量之和不可能是
A.0.120mol B.0.150mol C.0.0900mol D.0.100mol
17.被称之为“软电池”的纸质电池,采用一个薄层纸片作为传导体,在其一边镀锌,而在其另一边镀二氧化锰。在纸内的离子“流过”水和氧化锌组成的电解液。电池总反应为: Zn + 2 MnO2十H2O = ZnO + 2MnO (OH)2。下列说法正确的是
A.该电池的正极为锌
B.该电池反应中二氧化锰起催化剂作用
C.当 0.lmol Zn 完全溶解时,流经电解液的电子个数为 1.204×l023
D.电池正极反应式为: 2MnO2 + 2e一+ 2H2O = 2MnO (OH)2十2OH-
16.现有一块已知质量的铝镁合金,欲测定其中镁的质量分数,几位同学设计了以下三种不同的实验方案:实验设计1:铝镁合金 测定生成的气体在标准状况下的体积
测定生成的气体在标准状况下的体积
实验设计2:铝镁合金 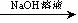 测定生成的气体在标准状况下的体积
测定生成的气体在标准状况下的体积
实验设计3:铝镁合金 溶液
溶液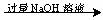 过滤,测定得到沉淀的质量
过滤,测定得到沉淀的质量
则能测定出镁的质量分数的是
A.都能 B.都不能 C.①不能,其它都能 D.②③不能,①能
15.由Mg、Cu、Fe、Al四种金属,若两两混合,取混合物26克与足量稀硫酸反应,产生标准状况下H2 11.2L,此混合物的可能组合的方式最多有
A 2种 B 3种 C 4种 D 5种
14.原电池的电极名称不仅与电极材料的性质有关,也与电解质溶液有关。下列说法中正确的是
A.由Fe、Cu、FeCl3溶液组成原电池,负极反应式为:Cu-2e-=Cu2+
B.由Al、Cu、稀硫酸组成原电池,负极反应式为:Cu-2e-=Cu2+
C.由Al、Mg、NaOH溶液组成原电池,负极反应式为:Mg-2e-=Mg2+
D.由Al、Cu、浓硝酸组成的原电池中,负极反应式为:Cu-2e-=Cu2+
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com