
题目列表(包括答案和解析)
29.有0.1mol/L的①NaX、②KY、③NH4Z三种盐溶液,常温下测得其pH关系为pH(NaX)>pH(KY) = pH(NH4Z) = 7,则(1)①HX、②HY、③HZ三种酸中肯定是强酸的是 (填序号,下同);
(2)①X-、②Y-、③Z-三种离子中最难结合H+的是 ;
(3)三种盐溶液中的c(H+)最小的是 ;
(4)下列反应一定可以发生的是
① Z- + H2O  HZ +
OH- ② KY + H2O
HZ +
OH- ② KY + H2O  KOH +
HY
KOH +
HY
③ HY + X- = HX + Y- ④ HZ + X- = HX + Z-
28.(1)在纯碱溶液中滴入酚酞试液,现象是 ,
原因(用离子方程式表示)是 ;
(2)若继续加入过量BaCl2溶液,现象是 ,
原因(用离子方程式和必要的文字说明)是 。
27.原电池的电极名称不仅与电极材料的性质有关,也与电解质溶液有关。下列说法中错误的是:
A.由Al、Cu、稀硫酸组成的原电池,其正极反应式为:2H++2e-= H2↑
B.由Al、Mg、NaOH溶液组成的原电池,其负极反应式为:Mg-2e- = Mg2+
C.由Fe、Cu、FeCl3 溶液组成的原电池,其正极反应式为:Fe3++e- = Fe2+
D.由Al、Cu、浓硝酸组成的原电池,其负极反应式为:Cu-2e- = Cu2+
25.某研究性学习小组为了探索镁粉与溴水反应的机理,做了如下四组实验:①将镁粉投入冷水中,未见任何现象;②将镁粉放入溴水中,观察到只是开始时产生极少量的气泡,但溴水的颜色逐渐褪去③将镁粉放入液溴中,未观察到任何明显现象;④向含足量镁粉的液溴中滴加几滴水,观察到溴的红棕色很快褪去。则下列关于镁与溴水的反应机理的论述中正确的是
A.镁粉只直接与溴水中的溴反应 B.镁粉只与溴水中的酸反应
C.产生极少量的气泡是由于镁粉与水反应得到 D.镁粉在水的催化下与溴发生反应
[ ] 26.在一密闭容器中,反应mA(g)
26.在一密闭容器中,反应mA(g)  nB(g) 达到平衡后,保持温度不变,改变容器体积(V)时,B的浓度变化如图所示,以下判断正确的是
nB(g) 达到平衡后,保持温度不变,改变容器体积(V)时,B的浓度变化如图所示,以下判断正确的是
A.物质B的质量分数增加 B.平衡向逆反应方向移动
C.物质A的转化率减小 D.化学计量数:m>n
23. 25℃时,0.1mol/L的一元酸HA溶液和0.1mol/L的一元碱BOH溶液的pH之和为13,现将两溶液等体积混合,下列有关叙述中正确的是
A.酸HA溶液的pH不可能为1 B.混合溶液中c(A-)=c(B+)
C.混合溶液显碱性 D.碱BOH一定是弱碱
[ ]

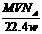 24.wg含有双键的不饱和烃X能与VL的氢气(标准状况)完全反应,若X的相对分子质量为M,阿伏加德罗常数为NA,则1 mol X中含有双键数目为
24.wg含有双键的不饱和烃X能与VL的氢气(标准状况)完全反应,若X的相对分子质量为M,阿伏加德罗常数为NA,则1 mol X中含有双键数目为
 A.
B.
C.
D.
A.
B.
C.
D.
22.一定条件下,可逆反应X(g)+3Y(g) 2Z(g),若X、Y、Z起始浓度分别为
2Z(g),若X、Y、Z起始浓度分别为 (均不为0),当达到平衡时X、Y、Z的浓度分别为0.1mol·L-1 、 0.3mol·L-1、 0.08mol·L-1 ,则下列判断不合理的是
(均不为0),当达到平衡时X、Y、Z的浓度分别为0.1mol·L-1 、 0.3mol·L-1、 0.08mol·L-1 ,则下列判断不合理的是
A.c1 : c2 = 1:3 B.平衡时,Y和Z的生成速率之比为3 :2
C.X、Y的转化率不相等
D. 的取值范围为 0<c1<0.14mol·L-1
的取值范围为 0<c1<0.14mol·L-1
21.向100mL0.2mol/L的NaOH溶液中通入标准状况下的CO2448mL,则最终溶液中粒子间关系不正确的是
A. c(Na+) + c(H+) = c(HCO3-) + c(CO32-) + c(OH-) B.c(H+) + c(H2CO3) – c(CO32-) = c(OH-)
C. c(Na+) > c(HCO3-) > c(OH-) > c(H+) > c(CO32-) D. c(HCO3-) + c(CO32-) + c(H2CO3) = 0.2mol/L
20.在100mL 0.1mol/L的醋酸溶液中,欲使醋酸的电离程度增大,H+浓度减小,可采用的方法是
A.加入少量浓醋酸 B.加入少量CH3COONa固体
C.加入少量的0.05mol/L的硫酸 D.加入少量NaCl溶液
18.有甲、乙两个烧杯,两杯中放等体积、等pH的溶液,甲中放盐酸溶液,乙中放醋酸溶液,向两烧杯中同时加入质量不等的锌粒,反应完全后收集到等量的氢气。下列说法正确的是
A. 甲烧杯中的锌比乙烧杯中的锌多 B. 甲烧杯中酸过量
C. 两烧杯中反应掉的锌的量不相等 D. 甲烧杯先反应结束
[ ] 19.某链烃CnHm在一定条件下,可以与氢气发生反应。取不同体积的CnHm和氢气做实验(两者体积之和为一定值V)。如图所示横坐标表示CnHm和H2占投料体积的百分率,纵坐标表示反应后气体的总体积,根据图像可确定n和m的关系是
19.某链烃CnHm在一定条件下,可以与氢气发生反应。取不同体积的CnHm和氢气做实验(两者体积之和为一定值V)。如图所示横坐标表示CnHm和H2占投料体积的百分率,纵坐标表示反应后气体的总体积,根据图像可确定n和m的关系是
A.m=2n+2 B.n=m/2 C.m=2n-2 D.m=2n-6
17.设NA为阿伏加德罗常数,下列叙述中不正确的是
A. pH=1的醋酸溶液中,CH3COO-和H+ 数目之和不为0.1 NA
B. 标准状况下,3.36L乙烯中含有的非极性键数为0.30 NA
C. 1 mol甲基(-CH3)所含电子数9NA
D. 1mol聚氯乙烯中含有的双键数目约为6.02×1023
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com