
题目列表(包括答案和解析)
22. (共4′) 金属Al单质晶体中原子的堆积方式如下图甲所示,其晶胞特征如下图乙所示,原子之间相互位置关系的平面图如下图丙所示。
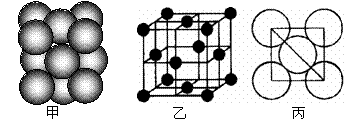
请回答:
⑴晶胞中Al原子的配位数为__ _ ,
⑵一个晶胞中Al原子的数目为_ _;
21.(共6′) 下表是一些键能数据kJ·mol-1):
|
|
键能 |
|
键能 |
|
键能 |
|
键能 |
|
H-H |
436 |
Cl-Cl |
243 |
H-Cl |
432 |
H-O |
464 |
|
S=S |
255 |
H-S |
339 |
C-F |
427 |
C-O |
347 |
|
C-Cl |
330 |
C-I |
218 |
H-F |
565 |
|
|
由表中数据能否得出这样的结论:
⑴半径越小的原子形成的共价键越牢固(即键能越大)_______(填“能”或“不能”) ⑵非金属性越强的原子形成的共价键越牢固________(填“能”或“不能”)。
⑶能否从数据找出一些规律,请写出一条:________________________________
___________________________________________________;
⑷试预测C-Br键的键能范围_________<C-Br键能<__________。
20.(共8′)利用价层电子对互斥模型,判断分子或离子的空间构型,CO32-、SO32-、NO2和ClO4-的空间构型分别为:
⑴CO32- ; ⑵SO32- ;
⑶NO2- ; ⑷ClO4- 。
19. (共8′) 现有八种物质:①干冰; ②金刚石; ③晶体硫; ④晶体硅; ⑤过氧化钠; ⑥二氧化硅晶体; ⑦溴化铵; ⑧氖,请用编号填写下列空白:
⑴通过非极性键形成原子晶体的是__________;
⑵固态时属于分子晶体的是_______;
⑶属于分子晶体,且分子为直线型的是______;
⑷由单原子分子构成的分子晶体的是_______;
⑸含有非极性键的离子化合物的是__________;
18.(共4′) 填写下列空白:
⑴写出表示含有8个质子、10个中子的原子的化学符号:___________________。
⑵周期表中位于第13纵行的镓元素属于第________族。
⑶周期表中最活泼的非金属元素位于第_____________纵行。
⑷所含元素为32种的周期是第____________周期。
17.(共4′) 用“>”或“<”完成下列填空。
⑴键的极性:H-C H-N。
⑵键角:C2H4 CH4
⑶分子中σ键数目:C2H4 CH4
⑷分子中π键数目:C2H4 C2H2
16.NH3分子空间构型是三角锥形,而CH4是正四面体形,这是因为
A.分子的中心原子杂化轨道类型不同,NH3为sp2型杂化,而CH4是sp3型杂化
B.NH3分子中N原子形成三个杂化轨道,CH4分子中C原子形成4个杂化轨道
C.NH3分子中有一对未成键的孤对电子,它对成键电子的排斥作用较强
D.NH3分子是极性分子而CH4是非极性分子
第Ⅱ卷(非选择题44分)
15.指出下列各组有机物分子中,分子里含有手性碳原子的是
A.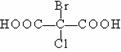 B.
B.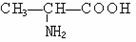
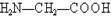 C.
D.CH3-CHFCl
C.
D.CH3-CHFCl
14.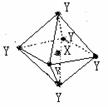 在某晶体中,与某一种微粒X距离最近且等距离的另一种微粒Y 所围成的空间构型为正八面体(如图)。该晶体可能是
在某晶体中,与某一种微粒X距离最近且等距离的另一种微粒Y 所围成的空间构型为正八面体(如图)。该晶体可能是
A.NaCl B.CsCl
C.CO2 D.SiO2
13.下列配合物的配位数不是6的是
A.K2[Co(NCS)4] B.Na2[SiF6]
C.Na3[AlF6] D. [Cu(NH3)4]Cl2
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com