
题目列表(包括答案和解析)
2.化石燃料及新能源
例1.“可燃冰”是天然气与水在一定条件下形成的晶体物质,化学式可用CH4·8H2O表示,主要存在于冻土层和海底大陆架中,每1 m3“可燃冰”能释放出20m3的甲烷气体.下列说法中不正确的是
A.“可燃冰”将成为人类新的后继能源 B.“可燃冰”是可再生能源
C.“可燃冰”具有清洁卫生的优点 D.我国青藏高原冻土层可能存在“可燃冰”
简析:“可燃冰”虽然在海底及冻土层中含量很多,但资源还是有限的,消耗多少,就减少多少,是一种不可再生的资源。
答案:B。
习题:
2.用水灭火的原理是
A.仅是降低温度 B.降低可燃物的着火点
C.仅是隔绝空气 D.既降低温度,又起隔绝空气的作用
答案:1 B;2 D。
1.下列关于燃烧的叙述不正确的是
A.燃烧一定是发光、发热的现象 B.有发光、发热的现象一定是燃烧
C.燃烧一定是化学反应 D.温度低于可燃物着火点,就不会燃烧
1.燃烧与灭火
例1.燃烧木柴时,通常把木柴架空才能燃烧得更旺,这是因为
A.使木柴与空气充分接触 B.木柴具有可燃性
C.温度易达到木柴的着火点 D.木柴架空容易散热
简析:物质燃烧必须具备三条件:具有可燃性、有氧气存在、温度达到可燃物的着火点。木柴架空后燃烧更旺是由于木柴与空气接触面增多,使木柴与空气充分接触。
答案:A。
例2.镁等活泼金属可以在二氧化碳中剧烈燃烧,金属钠遇水可能会发生爆炸,它们都不与煤油反应,有的还可以保存在煤油中。试推测比镁、钠都活泼的金属钾着火,可以用作灭火剂的是
A.水 B.干冰 C.黄沙 D.煤油
简析:钾的化学性质比钠、镁活泼。由此可推测钾能与CO2、水发生反应,因此,金属钾着火,不能用水、干冰来灭火。燃着的钾能点燃煤油。
答案:C。
习题:
9.科学家正研究在太空建一座把太阳光变成激光的装置,然后用激光照射添加了催化剂二氧化钛(TiO2)和水,水能有效地分解产生氢气和氧气,即2H2O 2H2↑+O2↑。某同学看到此化学方程式,即想到以下两点:①水在激光和催化剂TiO2的作用下,能分解产生氢气和氧气;②每36 g水可以分解生成4 g氢气和32
g氧气。你还能想到更多吗?请将你的想法填写到下面的空白中(再任写两点)。
2H2↑+O2↑。某同学看到此化学方程式,即想到以下两点:①水在激光和催化剂TiO2的作用下,能分解产生氢气和氧气;②每36 g水可以分解生成4 g氢气和32
g氧气。你还能想到更多吗?请将你的想法填写到下面的空白中(再任写两点)。
____________________________________________;
____________________________________________。
思路解析:此题考查对化学方程式表示意义的理解,要求从以下几个方面去理解,即元素种类、物质的总质量、各物质的质量比、原子数等在化学反应前后的变化。
答案:③每2个水分子分解产生2个氢分子和1个氧分子;④反应前后原子的个数不变;⑤反应前后元素种类不变,都是氢、氧元素(答案不唯一)
8.铜在空气中易生锈,生成一种叫“铜绿”的物质,其化学式为Cu2(OH)2CO3,它由碳、氢、氧、铜四种元素组成。小明设计了一个实验,证明铜生锈仅是由铜、氧气和水共同作用的结果。
(1)你认为小明的结论正确吗?为什么?
(2)你猜测铜生锈还可能有什么物质参加反应?
(3)怎样防止铜生锈?
思路解析:此题重在考查“化学反应前后,元素的种类不变”这条规律,同时也考查了同学们的生活经验和分析、解决问题的能力。隔绝空气和水,不满足铜生锈的条件,铜也就不会生锈了。
答案:(1)不正确;因为铜、氧气、水中没有碳元素,而“铜绿”中有碳元素,不符合“化学反应前后,元素种类不变”的规律。
(2)铜生锈还可能有二氧化碳参加。
(3)隔绝空气和水。
7.图5-1形象地表示某反应前后反应物与生成物分子及其数目的变化,其中分别表示A、B、C三种不同的分子。该反应的化学方程式中A、B、C前的化学计量数之比为( )
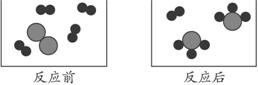
图5-1
A.4∶1∶3 B.3∶1∶2
C.4∶1∶2 D.3∶1∶3
思路解析:此题主要考查质量守恒定律和识图能力。反应前有4个A分子和1个B分子,反应后变成2个C分子和1个A分子,说明A分子没有完全反应。即3个A分子和1个B分子完全反应,生成2个C分子,因此该反应的化学方程式中A、B、C前的化学计量数之比为3∶1∶2。
答案:B
我创新 我超越
6.法轮功邪教组织的头目李洪志说,他发功能使铝发生化学反应,变成铜和金,使铝分子变成铜分子和金分子。请你根据所学的化学知识,指出这种说法违反科学之处。
思路解析:该说法违反科学之处有两点:(1)金属单质不是由分子构成的,而是由原子直接构成的。根本不存在铝分子、铜分子、金分子。(2)由质量守恒定律可知在化学反应里,元素的种类不发生改变。所以,铝根本不会变成铜和金。
5.在化学反应A+B====C+D中,已知5 g A与10 g B恰好反应生成了13 g C和若干克D,要制得4 g D时,参加反应为A的质量为_________。
思路解析:
A + B ==== C + D
5 g 10 g 13 g X=2 g
M 4 g
答案:10 g
我综合 我发展
4.根据质量守恒定律解释下列问题:
(1)镁条在空气中燃烧后,生成的白色粉末的质量比原来镁条的质量增加。
(2)碱式碳酸铜受热分解后,剩余的固体物质的质量比原反应物的质量减轻。
解答:(1)镁条燃烧后生成物的质量增加,是由于镁条在空气中燃烧时与空气中的氧气发生了化学反应,生成了白色固体物质氧化镁。
2Mg+O2 2MgO
2MgO
显然,依据质量守恒定律生成物氧化镁的质量应等于反应物镁条与氧气的质量之和。所以,氧化镁的质量要比镁条的质量大。
(2)依据质量守恒定律可知反应物碱式碳酸铜的质量应等于各生成物质量之和,即氧化铜与水与二氧化碳质量之和。由于在加热的条件下碱式碳酸铜分解后生成的水和二氧化碳都是气体,可以自由逃逸到空气中去,剩下的固体物质只有氧化铜,其质量肯定要小于碱式碳酸铜的质量。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com