
题目列表(包括答案和解析)
11、下列离子方程式正确的是:( )
A、向AlCl3溶液中滴入过量的氨水:Al3+ + 3NH3•H2O = Al(OH)3 ↓+ 3NH4+
B、向NaHCO3溶液中滴入少量的Ba(OH)2溶液:HCO3-+Ba2+ +OH- = BaCO3↓ + H2O
C、往Ca(ClO)2溶液中通入少量的SO2:Ca2+ + 2ClO-+ SO2 + H2O = 2HClO+ CaSO3↓
D、向FeI 2溶液中通入少量的Cl2:Cl2+2Fe2+==2Fe3++2Cl-
10、在一定条件下利用电解的方法可以将含有少量的Fe、Zn、Cu、Pt等金属杂质的粗镍提纯。下列叙述正确的是(已知氧化性:Fe2+<Ni2+<Cu2+):( )
A.纯镍作阳极 B.阳极发生还原反应
C.粗镍连接电源的正极,其电极反应为:Ni2++2e-== Ni
D.电解后,电解槽底部有含有Cu和Pt等金属杂质的阳极泥
9、以惰性电极电解CuSO4溶液,若阳极上产生的气体的物质的量为0.0100 mol,则阳极上析出Cu的质量为( )
A.0.64 g B.1.28 g C.2.56 g D.5.12g
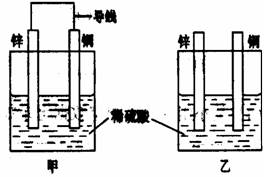
8、关于如右图所示装置的叙述,正确的是:( )
A.两装置中锌片都发生氧化反应
B.两装置中溶液的pH均不变
C.两装置中铜片的质量均逐渐减小
D.两装置中铜片表面均无气泡产生
7、已知甲酸钠(HCOONa)溶液呈碱性。室温下用c(H+)相同,体积相同的盐酸与甲酸(HCOOH)溶液分别进行如下实验,相关叙述正确的是:( )
A.加水稀释,两溶液中的氢离子数目都不变
B.用等浓度的NaOH溶液中和,盐酸比甲酸消耗的碱液少
C.跟等质量铝粉反应,盐酸比甲酸的起始反应速率快
 D.跟过量的锌粒反应,盐酸比甲酸产生氢气的量多
D.跟过量的锌粒反应,盐酸比甲酸产生氢气的量多
6、已知Zn(s)+H2SO4(aq)== ZnSO4(aq)+H2(g),△H<0;则下列关于该反应的叙述不正确的是:( )
A、该反应中旧键断裂需吸收能量,新键形成需放出能量,所以总能量不变
B、下述热化学方程式中的△H的值与反应物的用量无关
C、该反应的化学能可以转化为电能
D、反应物的总能量高于生成物的总能量
5、下列反应的离子方程式书写正确的是:( )
A.硫酸镁溶液与氢氧化钡溶液反应:SO42-+Ba2+== BaSO4↓
B.氯气通入冷水中: Cl2+ H2O== ClO-+Cl-+2H+
C.金属铝溶于氢氧化钠溶液:2Al+6OH-==2AlO2-+3H2↑
D.澄清石灰水与碳酸氢钙溶液反应:Ca2++HCO3-+OH-== CaCO3↓+H2O
4、已知:①向KClO3晶体中滴加浓盐酸,产生黄绿色气体;②向NaI溶液中通入少量实验①产生的气体,溶液变黄色;③取实验②生成的溶液滴在淀粉KI试纸上,试纸变蓝色。下列判断正确的是:( )
A.实验③说明KI被氧化 B.实验②中氧化剂与还原剂的物质的量之比为2:1
C.实验①证明Cl-具有还原性 D.上述实验证明氧化性:ClO3-< Cl2<I2
3、下列说法正确的是( )
A 原子晶体中只存在非极性共价键 B 稀有气体形成的晶体属于分子晶体
C 干冰升华时,分子内共价键会发生断裂
D 金属元素和非金属元素形成的化合物一定是离子化合物
2、为达到预期的实验目的,下列操作正确的是( )
A.欲配制质量分数为10%的ZnSO4溶液,将l0 g ZnSO4·7H2O溶解在90 g水中
B.欲制备F(OH)3胶体,向盛有沸水的烧杯中滴加FeCl3饱和溶液并长时间煮沸
C.为鉴别KCl、AICl3和MgCl2溶液,分别向三种溶液中滴加NaOH溶液至过量
D.为减小中和滴定误差,锥形瓶必须洗净并烘干后才能使用
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com