
题目列表(包括答案和解析)
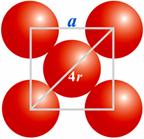
25.已知金属铜为面心立方晶体,如图所示,铜的相对原子质量为63.54,密度为8.936g/cm3,试求:
(1).图中正方形边长 a.
(2).铜的金属半径 r. (说明: a和r只要用原始数据列出表示式即可)

24.(8分)有原子序数小于20的A、B、C、D、E、F六种元素,它们的原子序数依次增大. 已知B元素是地壳中含量最多的元素; A和C的价电子数相同,B和D的价电子数也相同,且A和C两元素原子核外电子数之和是B、D两元素原子核内质子数之和的二分之一;C、D、E三种元素的基态原子具有相同的电子层数,且E原子的p轨道上电子数比D原子的p轨道上多一个电子;六种元素的基态原子中,F原子的电子层数最多且和A处在同一主族.回答下列问题:
(1).用电子式表示C和E形成化合物的过程 .
(2).写出基态F原子的核外电子排布式 .
(3).用电子式表示A原子与D原子形成A2D分子的过程 .
(4). A、B、C共同形成的化合物中化学键的类型____________.
23.(10分)有A、B、C、D、E、F六种元素,已知:
①.它们位于三个不同短周期,核电荷数依次增大.
②.E元素的电离能数据见下表(kJ·mol-1):
|
I1 |
I2 |
I3 |
I4 |
… |
|
496 |
4562 |
6912 |
9540 |
… |
③.B与F分别同主族.
④.A、E分别都能与D按原子个数比1﹕1或2﹕l形成化合物.
⑤.B、C分别都能与D按原子个数比1﹕1或1﹕2形成化合物.
⑴.写出只含有A、B、D、E四种元素的两种无水盐的化学式 、 .
(2).B2A2分子中存在____个σ键,_____个兀键.
(3).人们通常把拆开l mol某化学键所吸收的能量看成该化学键的键能。键能的大小可以衡量化学键的强弱,也可以用于计算化学反应的反应热(△H),化学反应的△H等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差。下表列出了上述部分元素形成的化学键的键能:
|
化学键 |
F-D |
F-F |
B-B |
F-B |
C═D |
D═D |
|
键能/kJ·mol-1 |
460 |
176 |
347.7 |
347 |
745 |
497.3 |
①.下列三种物质形成的晶体,熔点由高到低的顺序(用a、b、c表示): .
a.F与B形成的化合物 b.B与D形成的稳定化合物 c.F的单质 d. E与D形成的化合物
②.试计算1molF单质晶体燃烧时的反应热:____________________________________.
22.(9分)A、B、C三种短周期元素,原子序数依次增大,三种元素序数之和为36,A、C同族,B2+离子核外有10个电子,回答下列问题:
(1).A、B、C三种元素的符号分别是_________ 、 _________ 、_________.
(2).A、B、C之间任取两种能形成多种化合物,其中属于共价化合物的化学式分别为_________ 、___________.
(3).分别写出A、B的电子排列式:A._____________________、B.____________________.
(4).写出C的价电子轨道式:_____________________.
21.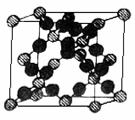 (4分)我们可以将SiO2的晶体结构想象为:在晶体硅的Si-Si键之间插入O原子.结构如右图所示.
(4分)我们可以将SiO2的晶体结构想象为:在晶体硅的Si-Si键之间插入O原子.结构如右图所示.
⑴.根据SiO2晶体结构图,下列说法正确的是_________.
A.石英晶体中每个Si原子通过Si-O极性键与4个O原子作用
B.每个O原子也通过Si-O极性键与2个Si原子作用
C.石英晶体中Si原子与O原子的原子个数比为1∶2,可用“SiO2” 来表示石英的组成
D.在晶体中存在石英分子,故能叫分子式
(2).SiO44-离子结构可用 图表示,在聚硅酸根离子Si2O76-中只有硅氧键,它的结构应是_____________ .
图表示,在聚硅酸根离子Si2O76-中只有硅氧键,它的结构应是_____________ .
20.(8分)已知元素的某种性质“X”和原子半径、金属性、非金属性等一样,也是元素的一种基本性质.下面给出13种元素的X的数值:
|
元素 |
Al |
B |
Be |
C |
Cl |
F |
Li |
|
X的数值 |
1.5 |
2.0 |
1.5 |
2.5 |
2.8 |
4.0 |
1.0 |
|
元素 |
Mg |
Na |
O |
P |
S |
Si |
|
|
X的数值 |
1.2 |
0.9 |
3.5 |
2.1 |
2.5 |
1.7 |
|
试结合元素周期律知识完成下列问题:
(1).经验规律告诉我们:当形成化学键的两原子相应元素的X差值大于1.7时,所形成的一般为离子键;当小于1.7时,一般为共价键.试推断BeCl2中的化学键类型是______.
(2).根据上表给出的数据,简述主族元素X的数值大小与元素的金属性或非金属性强弱之间的关系____________________ ____ __________.
(3).请你预测Br与I元素的X数值的大小关系________.
(4).某有机化合物分子中含有S-N键,你认为该共用电子对偏向于________原子(填元素符号).
19.(11分)在短周期主族元素中:
(1).属于非金属元素但又具有一定的金属性,可作半导体材料的是________(填元素名称).
(2).铝是活泼的金属元素,单质铝由于 而具有良好的抗腐蚀能力.美国化学家发现铝的“原子群”(如Al13、Al14、Al37)各具有与某种元素相似的化学性质,并符合元素周期律中的某些规律.例如:Al13与卤素具有相似的化学性质, Al13-离子具有惰性气体元素的性质,可推测Al14的化学性质与 族元素相似.
(3).甲、乙两种元素是同一周期的相邻元素,甲元素是形成有机物的主要元素,乙元素的p 亚层上有3个电子.
①.写出甲元素的电子排布式____________,乙元素的原子结构示意图________________.
②.甲、乙元素可形成硬度大于金刚石的一种化合物,该化合物属于____________晶体,其化学式为_______________.
18.假设原子晶体SiO2中Si原子被铝原子取代,不足的价数由钾原子补充.当有25%的硅原子被铝原子取代时,可形成正长石.则正长石的化学组成为
A.KAlSiO4 B.KAlSi2O6 C.KAlSi2O8 D.KAlSi3O8
第Ⅱ卷(非选择题 共56分)
请将选择题的答案填在下表中.
17.在高压下氮气会聚合生成高聚氮,这种高聚氮的晶体中每个氮原子都通过三个单键与其它氮原子结合并向空间发展构成立体网状结构.已知晶体中N-N键的键能为160 kJ·mol-1,而N≡N的键能为942 kJ·mol-1.则下列有关说法不正确的是
A.键能越大说明化学键越牢固,所构成物质越稳定
B.高聚氮晶体属于原子晶体
C.高聚氮晶体中n(N)∶n(N-N)=1∶3
D.用作炸药可能是高聚氮潜在的应用
16.纳米材料的表面微粒数占微粒总数的比例极大,这是它有许多特殊性质的
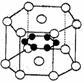 原因.假设某纳米颗粒中粒子分布类似于硼镁化合物,其结构如图所示,
原因.假设某纳米颗粒中粒子分布类似于硼镁化合物,其结构如图所示,
则这种纳米颗粒的分子式为
A.MgB B.Mg3B6 C.Mg5B12 D.Mg14B6
( 镁原子○位于顶点和上下两个面心,硼原子●位于内部 )
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com