
题目列表(包括答案和解析)
2.(3分) ② …………………………………………………………………1分
① ……………………………………………………………………1分
③ ……………………………………………………………………1分
1.(3分)HNO3 ………………………………………………………………1分
C ………………………………………………………………………1分
4 ………………………………………………………………………1分
10.(4分)Fe和Al是两种重要的金属,将它们按一定的质量比组成混合物。
(1)取一定质量的该混合物,若加入足量的NaOH溶液,生成的气体在标准状况下体积为n L;若加入足量的稀硫酸,生成的气体在标准状况下体积为m L。则原混合物中Fe的物质的量为 mol(用含n、m的代数式表示)。
(2)取一定质量的该混合物,在纯氧中充分燃烧。向所得产物中加入过量的NaOH溶液,充分反应后将不溶物过滤、洗涤、干燥后称量,测得该不溶物的质量与原混合物的质量恰好相等。则原混合物中Fe与Al的质量比为 。
9.(4分)将标准状况下11.2 L NH3与足量的HNO3溶液充分反应。试计算:
(1)生成NH4NO3的物质的量为多少?
(2)生成NH4NO3的质量为多少?
8.(8分)实验室制取乙烯时,常伴有少量SO2等杂质气体生成。现利用下图所示装置制取较纯净的乙烯,并检验乙烯的化学性质。
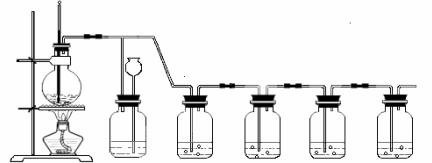
请回答:
(1)实验室制取乙烯的化学方程式为 。
(2)装置B可检验后续装置中是否发生堵塞。若发生堵塞,则B中的现象为 。
(3)装置C、D中所盛试剂的作用依次是 。
(4)根据装置E中的实验现象,可以说明乙烯是否具有不饱和性。下列反应能说明乙烯具有不饱和性的是 (填序号)。
①水解反应 ②加成反应 ③加聚反应 ④消去反应 ⑤酯化反应
7.(8分)利用右图装置,选用适当试剂,可完成实验(1)和(2),并得出相应的实验结论(见下表)。
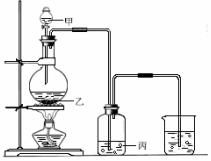
请填写表中的空格(从A-H中选择,填字母):
|
实验 |
所
用 试 剂 |
实验结论 |
||
|
甲 |
乙 |
丙 |
||
|
(1) |
浓盐酸 |
|
KI淀粉 溶液 |
|
|
(2) |
|
Cu |
|
SO2具有 漂白性 |
A.浓硫酸 B.品红溶液 C.NaCl粉末
D.MnO2粉末 E.澄清石灰水 F.NaOH溶液
G.氧化性:Cl2 >I2 H.浓硫酸具有氧化性
6.(4分)右图是实验室制取氨气的装置图。请回答:
(1)实验室制取氨气的化学方程式为
。
(2)因为氨气的密度比空气的
(填“大” 或“小”),所以收集氨气的方法
是 (填序号)。
① 向上排空气法 ② 向下排空气法
(3)干燥氨气可选用的试剂是
(填序号)。
① 碱石灰 ② 浓硫酸
5.(8分)现有原子序数依次增大的X、Y、Z、W四种短周期元素。X与W同主族。Y与Z同周期且位置相邻,其单质在常温下均为无色气体。W的质子数等于Y与Z两原子的最外层电子数之和。
已知Z与W可形成离子化合物W2Z2 ,X与Y可形成阳离子YX4+ ,X、Y、Z可形成化合物XYZ3。请回答:
(1)W在元素周期表中的位置为 。
(2)W2Z2与水反应的离子方程式为 。
(3)实验室中检验YX4+ 的操作方法及有关实验现象是:
取少量含YX4+的溶液,
,则证明溶液中含有YX4+。
(4)XYZ3在一定条件下易发生分解反应,若反应中转移电子数为9.03×1022,则有 mol XYZ3发生分解。
4.(4分)钠、铝和铁是三种重要的金属。请回答:
(1)三种金属中,常温下遇浓硫酸或浓硝酸不会发生钝化现象的是 (填化学式);既能与酸反应,又能与碱反应的是 (填化学式)。
(2)三种金属在一定条件下均能与水发生反应。其中铁与水蒸气在高温下反应的化学方程式为 ;钠与水反应时可观察到的实验现象有 (填字母)。
a.钠浮在水面上 b.钠熔成小球 c.钠四处游动 d. 溶液变为红色
3.(4分)某无色溶液由①K+、②Cl-、③Al3+、④SO42-中的若干种离子组成。取部分该溶液,分装在四支试管中,分别进行实验:
(1)进行焰色反应,透过蓝色钴玻璃观察火焰呈紫色,说明一定含有的离子是 (填序号,下同)。
(2)滴加氢氧化钠溶液,产生白色沉淀,继续滴加,白色沉淀逐渐消失,说明一定含有的离子是 。
(3)加入少量稀硝酸使溶液酸化,再加入硝酸钡溶液,无白色沉淀产生,说明不含有的离子是 。
(4)加入少量稀硝酸使溶液酸化,再加入硝酸银溶液,产生白色沉淀,说明一定含有的离子是 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com