
题目列表(包括答案和解析)
20、一种新型熔融盐燃料电池具有高发电效率而倍受重视。现有Li2CO3和Na2CO3
的熔融盐混合物作电解质,一极通CO气体,另一极通O2和CO2的混合气体,
制作650℃时工作的燃料电池,其电池总反应是2CO+O2=2CO2。则下列说法中
正确的是:
A.通CO的一极是电池的正极
B.负极电极反应是:O2+2CO2+4e- = 2CO32-
C.熔融盐中CO32-的物质的量在工作时保持不变
D.正极发生氧化反应
19、有一碱性溶液250mL,它可能是NaOH、Na2CO3、NaHCO3中的一种或两种。若加入足
量的稀盐酸,产生的挥发性气体用足量的Ba(OH)2溶液吸收,可得14.775g的白色沉淀物。另取相同体积的该碱性溶液,恰能使浓度为0.625mol/L的NaOH溶液100mL完全反应。该碱性溶液的可能组成是:
A.NaOH、Na2CO3
B.NaHCO3、Na2CO3
C.只含NaHCO3
D.只含Na2CO3
18、下列物质在一定条件下能跟某些金属单质,非金属单质、酸、碱均发生反应的是:
A.FeCl2 B.Fe2O3 C.HF D.NaHCO3
17、 已知化合物A(C4Si4H8)与立方烷(C8H8)的分子结构相似,如右图:则C4Si4H8的二氯代物的同分异构体数目为:
已知化合物A(C4Si4H8)与立方烷(C8H8)的分子结构相似,如右图:则C4Si4H8的二氯代物的同分异构体数目为:
A.3 B.4
C.5 D.6
16、下列各反应的化学方程式中,属于水解反应的是:
A.H2O+H2O H3O+ +OH- B.HCO
H3O+ +OH- B.HCO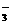 +OH-
+OH- H2O+CO
H2O+CO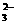
C.CO2+H2O
 H2CO3 D.CO
H2CO3 D.CO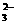 +H2O
+H2O HCO
HCO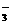 +OH-
+OH-
15、下列的实验操作中所用仪器合理的是:
A.用25mL的碱式滴定管量取14.80mL NaOH溶液
B.用100mL量筒量取5.2mL盐酸
C.用托盘天平称取25.20g氯化钠
|
14、下列离子方程式正确的是:
A.亚硫酸钠与稀硝酸反应:SO32-+H+ = H2O+SO2↑
B.向水玻璃中通入过量CO2:SiO32-+2CO2+2H2O = H2SiO3↓+2HCO3-
C.铜片加入稀硝酸中:Cu+NO3-+4H+ = Cu2++NO↑+2H2O
D.Al2O3与氢氧化钠溶液反应:Al2O3+OH-= AlO2-+H2O
13、某酸式盐NaHY的水溶液显碱性,下列叙述正确的是:
A.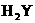 的电离方程式:
的电离方程式: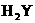


B. 离子的水解方程式:
离子的水解方程式:

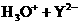
C.该酸式盐溶液中离子浓度关系:
D.该酸式盐溶液中离子浓度关系:
12、在某化学反应中,某一反应物浓度是1.0mol/L,经过10s后,它的浓度变成了0.6mol/L,在这10s内,用该反应物表示的平均反应速率为:
A.0.04mol/(L·s) B.0.08mol/(L·s)
C.0.8mol/(L·s) D.0.08mol/L
11、下列各组顺序的排列不正确的是:
A.离子半径:F->Na+>Mg2+>Al3+
B.热稳定性:HCl>H2S>PH3>AsH3
C.酸性:H3AlO3<H2SiO3<H2CO3<H3PO4
D.熔、沸点:NaCl>Na>CO2>SO2
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com