
题目列表(包括答案和解析)
2、氢原子的电子云图中小黑点表示的意义是( )
A、1个小黑点表示一个电子
B、小黑点的多少表示电子个数的多少
C、表示电子运动的轨迹
D、表示电子在核外空间出现机会的多少
1、关于原子结构模型的演变过程,正确的是( )
A、汤姆逊原子模型→道尔顿原子模型→卢瑟福原子模型→玻尔原子模型→量子力学模型
B、汤姆逊原子模型→卢瑟福原子模型→玻尔原子模型→量子力学模型→道尔顿原子模型
C、道尔顿原子模型→卢瑟福原子模型→汤姆逊原子模型→玻尔原子模型→量子力学模型
D、道尔顿原子模型→汤姆逊原子模型→卢瑟福原子模型→玻尔原子模型→量子力学模型
26.⑴ 80% ⑵ > 若PA=PB,则n(Z)B=n(W)A,事实上PA<PB,A中平衡要向左移动 ⑶ 0.2 a (每小题4分)
21. (8分)(1)(每条曲线1分)
(8分)(1)(每条曲线1分)
(2)> (2分)
(3)大于零的任意值 (3分)
21.(1)CD (2)0.91 1.45 (3) c(NH4+)>c (SO42-)>c (H+)>c (OH-)
28. (12分)如图所示,B中隔板可自由滑动。关闭K并向A中充入1 mol X、1 mol Y,向B中充入2 mol X、2 mol Y,起始时,V(A)=V(B)=a L。在相同温度和有催化剂存在的条件下,两容器中各自发生反应:2X(g)+2Y(g)
(12分)如图所示,B中隔板可自由滑动。关闭K并向A中充入1 mol X、1 mol Y,向B中充入2 mol X、2 mol Y,起始时,V(A)=V(B)=a L。在相同温度和有催化剂存在的条件下,两容器中各自发生反应:2X(g)+2Y(g) Z(g)+2W(g);ΔH<0,达到平衡Ⅰ时,V(B)=0.8a L。
Z(g)+2W(g);ΔH<0,达到平衡Ⅰ时,V(B)=0.8a L。
请计算:⑴B中X的转化率α (X)B。
⑵B中Z和A中W的物质的量比较:n(Z)B n(W)A(选填:“>”、“<”或“=”);原因是:


























































 。(限30个字内)
。(限30个字内)
⑶打开K,过一段时间重新达到平衡Ⅱ时,B的体积为多少?(用含a的代数式表示,连通管中气体体积忽略不计)。
(1)增大氮气和氢气的浓度有利于增大反应速率(2分);减小氨气的浓度,增大氮气和氢气的浓度均有利于平衡向正反应方向移动(3分)
26. (8分)如图1,将2
mol SO2和1 mol O2混合置于
(8分)如图1,将2
mol SO2和1 mol O2混合置于
体积可变的密闭容器中,在T1温度下发生如下反应:
 2SO2(g)+O2(g)
2SO2(g)+O2(g) 2SO3(g);△H<0。
2SO3(g);△H<0。
当反应进行到时间t0时达到平衡状态,
测得混合气体的总物质的量为2.1 mol。
试回答:
(1)在图2中作出反应混合物中各组分气体
的物质的量随反应进行到t0时的变化曲线;
(2)当反应进行到t1时间时(t1>t0),给上述反应
容器加热到温度为T2 (T2>T1),反应在t3 时间时(t3>t1)重新达到平衡状 态,新平衡混合物中气体的总物质的量 ________2.1 mol(填“<”、“>”或“=”)。
(3)若起始时加入0.6 mol SO2、0.3 mol O2和x mol SO3,保持温度不变,达到平衡状态后,各气体的体积分数与上述平衡状态相同,x的值为__________。
|
 CH3OH(g),经5min后到达平衡状态,若此时测得CH3OH蒸气的浓度为2mol·L-1
CH3OH(g),经5min后到达平衡状态,若此时测得CH3OH蒸气的浓度为2mol·L-1
求:(1)以H2的浓度变化表示的该反应的速度;
(2)达到平衡时CO的转化率。
25.(8分)一定温度下,在容积固定的密闭容器中进行反应:H2(g)+Br2(g)  2HBr(g)。已知加入 1mol H2和 2 mol Br2时,达到平衡后生成a mol HBr(见下表“已知”项)。在相同条件下,且保持平衡时各组分的物质的量分数不变,对下列编号(1)~(3)的状态,填写表中的空白:
2HBr(g)。已知加入 1mol H2和 2 mol Br2时,达到平衡后生成a mol HBr(见下表“已知”项)。在相同条件下,且保持平衡时各组分的物质的量分数不变,对下列编号(1)~(3)的状态,填写表中的空白:
|
编号 |
起始状态(mol) |
平衡时HBr物质的量 (mol) |
赋分 |
||
|
H2 |
Br2 |
HBr |
|||
|
已知 |
1 |
2 |
0 |
a |
|
|
⑴ |
2 |
4 |
0 |
|
2分 |
|
⑵ |
|
|
1 |
0.5a |
4分 |
|
⑶ |
m |
n(n≥2m) |
|
(n-m)a |
2分 |
24.(10分)化学工业在国民经济中占有极其重要的地位,江苏省是国内最早的硫酸生产基地之一。
(1)硫酸生产中,根据化学平衡原理来确定的条件或措施有 (填写序号)。
A.矿石加入沸腾炉之前先粉碎 B.使用V2O5作催化剂
C.接触室中不使用很高的温度 D.净化后炉气中要有过量的空气
E.接触氧化在常压下进行 F.吸收塔中用98.3%的浓硫酸吸收SO3
(2)若实验室在537℃、1.01×105Pa和催化剂存在条件下,向某密闭容器中充入1 mol SO2和0.5 mol O2,此时体积为100 L。在温度压强不变条件下反应达到平衡,SO2体积分数为0.06。若保持温度压强不变,充入1 mol SO3,则平衡时SO3的体积分数为 ;若保持温度和体积不变,充入a mol SO2和b mol O2,且a∶b=2∶1,反应达到平衡时SO2体积分数仍为0.06,则a= 。
(3)硫酸工业的尾气中含有少量的SO2,常加氨水吸收后再加硫酸回收SO2,同时得到化肥硫酸铵,硫酸铵溶液中各离子物质的量浓度由大到小的顺序为 __ __。
23.(9分)将等物质的量的A、B、C、D四种物质混和,发生如下反应:

当反应进行一定时间后,测得A减少了n
mol,B减少了 ,C增加了
,C增加了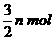 ,D增加了n
mol,此时达到化学平衡:
,D增加了n
mol,此时达到化学平衡:
(1)该化学方程式中各物质的系数为a=_______,b=______,c_______,d=_____。
(2)若只改变压强,反应速率发生变化,但平衡不发生移动,该反应中各物质的聚集状态A_______________,B______________,D_______________。
(3)若只升高温度,反应一段时间后,测知四种物质的量又达到相等,则该反应
为_________________反应(填放热或吸热)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com