
题目列表(包括答案和解析)
17.(12分)回答有关氯气制备的几个问题
实验室用浓盐酸、二氧化锰共热制氯气,并用氯气和Ca(OH)2制取少量漂白粉。现已知反应:2Cl2+2Ca(OH)2 Ca(ClO)2+CaCl2+2H2O,该反应是放热反应,温度稍高即发生副反应:6Cl2+6Ca(OH)2 Ca(ClO3)2+5CaCl2+6H2O。现有两个同学分别设计的两套实验装置如下图:
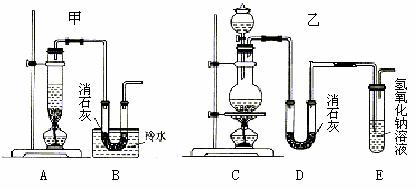
(1)写出制取氯气的化学方程式 。
(2)请从以下几个方面对甲乙两套实验装置的优缺点作出评价,并将符合题目要求的
选项的序号填在表格中。
a.不容易控制反应速率;b.容易控制反应速率;c.有副反应发生;d.可防止副反应发生;e.污染环境;f.可防止污染环境。
|
|
优 点 |
缺 点 |
|
甲装置 |
|
|
|
乙装置 |
|
|
(3)上述装置中甲由A、B两部分组成,乙由C、D、E三部分组成,请从上述装置中选取合理的部分,组装一套较完整的实验装置,装置各部分连接顺序是 (按气流流动的方向) 。该组合中还缺少的装置是 ,原因是 。
(4)实验室若用16mol/L的盐酸100mL与足量的二氧化锰反应,理论上最终生成的次氯酸钙的物质的量最多不超过 mol。
16.(18分)某学校设计了一节实验活动课,让学生从废旧干电池中回收碳棒、MnO2、NH4Cl、ZnCl2等物质。整个实验过程如下,请回答有关问题:
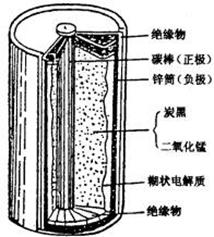
(1)干电池的基本构造和工作原理。
上图为干电池的基本构造图。干电池工作时负极的电极反应式是__________________。
正极上的电极反应式是_______________ (已知NH4+的得电子能力大于Zn2+)。MnO2的作用是除去正极上产物,本身生成Mn2O3,反应的化学方程式为: 。而淀粉糊的作用是提高阴、阳离子在两个电极的迁移速率。
(2)锌皮和碳棒的回收。
用钳子和剪刀剪开回收的干电池的锌铜,将锌皮和碳棒取出,并用毛刷刷干净,将电池内的黑色粉末移入小烧杯中。
(3)氯化铵、氯化锌的提取、检验和分离。
①如何从黑色粉末中提取NH4Cl和ZnCl2等晶体的混合物?写出简要的实验步骤: _ _____ _________。
②设计简单的实验证明所得晶体中含有NH4+。
实验步骤:_____ _____________。
实验现象:_____ _____________。
有关的离子方程式:_____ ___________。
③用 方法可将NH4Cl和ZnCl2的晶体混合物分离开,实验原理用方程式表示为__________ ________。
④最后剩余的黑色残渣的主要成分是MnO2,还有炭黑和有机物等。可用灼烧的方法除去杂质,该实验中需要用到的两种主要仪器有__________________。
15.在一密封的烧瓶中注入NO2,在250C时建立平衡状态,若把烧瓶置于1000C的水中,则下列说法正确的是:
A、烧瓶中混合气体的颜色变深 B、烧瓶中混合气体密度变小
C、烧瓶中混合气体的平均分子质量不变 D、烧瓶中N2O4的质量变小
卷II(70分)
14.用以下三种途径来抽取相同质量的硝酸铜:①铜与浓硝酸反应;②铜与稀硝酸反应;③铜与氧气反应生成CuO,CuO再与稀硝酸反应。下列有关叙述不正确的是
A、所消耗的硝酸的量:①>②>③
B、 对环境造成的危害,③最小
C、 因铜与浓硝酸作用最快,故制取硝酸铜的最佳方案是①
D.三种途径所消耗的铜的质量不相等
13.在最原始的大气中,含有大量的CO2但几乎不含有O2。而在当今的大气中却含有近21%的氧气,而CO2的含量却很少。请你结合所学知识推测产生以上变化的原因是
A.大量的火山喷发
B.远古时代绿色植物的光合作用
C.强紫外线使水分解而释放出O2和H2
D.火山熔岩流入水体中,使水在高温下分解
12.化学反应可视为旧健断裂和新键形成的过程,化学键的键能是形成(或拆开)1mol
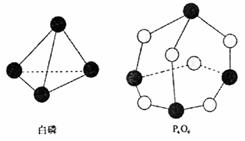 化学键时释放(或吸收)出的能量。已知
化学键时释放(或吸收)出的能量。已知
白磷和P4O6的分子结构如右图所示,现提
供以下化学键的键能(kJ·mol-1)P-P:
198 P-O:360 O==O:498则反应P4
(白磷)+3O2→P4O6的能量变化为
A.释放1638kJ的能量
B.吸收1638kJ的能量
C.释放126kJ的能量 D.吸收126kJ的能量
11.燃料电池是目前正在探索的一种新型电池,现在已经使用的氢氧燃料电池的基本反应是:x 极:O2(g) + 2H2O(l) + 4e- → 4OH- y极:2H2(g) + 4OH-- 4e-→ 4H2O(l) +
判断下列说法中正确的是
A、x极发生氧化反应 B、x极是负极
C、y极发生氧化反应 D、电子由x极流向y极
10.把a、b、c、d四块金属板浸入稀H2SO4中,用导线两两相连,可以形成原电池。若a、b相连时,a为负极;c、d相连时,c为负极;a、c相连时,c极上产生大量气泡,b、d相连时,b极上有大量气泡。则四块金属的活动顺序是
A.a>c>d>b B.c>a>b>d C.a>c>b>d D.c>a>d>b
9.二氧化氯、铁酸钠以及次氯酸是饮用水的“三净客”,用铁酸钠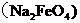 处理来自河流湖泊的水,以作为人们生活饮用水,是一项较新的技术。以下叙述中正确的是
处理来自河流湖泊的水,以作为人们生活饮用水,是一项较新的技术。以下叙述中正确的是
1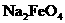 溶液有强酸性 2
溶液有强酸性 2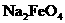 溶液有强氧化性 3
溶液有强氧化性 3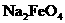 溶液有强还原性4该过程中水被消毒和净化
溶液有强还原性4该过程中水被消毒和净化
A.13 B.34 C.12 D.24
8.在自来水的生产中,常通入适量氯气进行杀菌消毒,氯气与水反应的产物之一是盐酸.市场上有些不法商贩为牟取暴利,利用自来水冒充纯净水桶装出售,为辨别真伪,可用下列哪一种试剂来鉴别?
A.酚酞试液 B.氯化钡溶液
C.氢氧化钠溶液 D.硝酸银溶液
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com