
题目列表(包括答案和解析)
17.化学用语是学习化学的重要工具,下列表示物质变化的化学用语中,错误的是
A.向KHSO4溶液中滴人Ba(OH)2溶液使pH=7 : BD
SO42- + 2H+ + Ba2+ + 2OH- = BaSO4↓ + 2H2O
B.明矾水解的离子方程式: Al3++3 H2O===Al(OH)3 ↓+3H+
C.Mg(HCO3)2 溶液与盐酸溶液反应的离子方程式:HCO3-+ H+ == CO2↑+H2O
D.常温常压下,1g氢气充分燃烧生成液态水,放出142.9 kJ热量。则表示氢气燃烧的热化学方程式: 2H2(g)+O2(g)=2H2O(l);△H=+571.6kJ·mol-1
16.常温,某溶液中由水电离产生的c(H+)、c(OH-)满足c(H+)·c(OH-)=10-24,则下列各组离子在该溶液中一定可以大量共存的是 D
A.K+、Na+、AlO2-、Cl- B.Na+、Cl-、SO42-、HCO3-
C.NH4+、Na+、NO3-、SO42- D.Ba2+、Na+、Cl-、NO3-
15.某恒温恒容的容器中,建立如下平衡:2NO2(g) N2O4(g),在相同条件下,若分别向容器中通入一定量的NO2气体或N2O4气体,重新达到平衡后,容器内N2O4的体积分数比原平衡时 A
N2O4(g),在相同条件下,若分别向容器中通入一定量的NO2气体或N2O4气体,重新达到平衡后,容器内N2O4的体积分数比原平衡时 A
A.都增大 B.都减小 C.前者增大后者减小 D.前者减小后者增大
14.反应 A+B → C 的反应速率方程式为:v = k c (A) c (B), v为反应速率, k为速率常数。当c (A) = c (B) = 1mol/L时,反应速率在数值上等于速率常数。下列说法正确的是 A
A.只增大c (A)时,v也增大 B.只增大c (A)时,v值不变
C.只升高温度时,k值不变 D.只升高温度时,k值变小
13.常温下,某学生用0.1 mol·L-1H2SO4溶液滴定0.1 mol·L-1NaOH溶液,中和后加水至100 mL。若滴定终点的判定有误差:①少滴了一滴H2SO4溶液;②多滴了一滴H2SO4溶液(1滴为0.05 mL),则①和②两种情况下所得溶液的pH之差是 D
A.4 B.4.6 C.5.4 D.6
12.在一定温度下的定容密闭容器中,当下列物理量不再变化时,不能表明反应:
A(固)+2B(气) C(气)+D(气)已达平衡的是 A
C(气)+D(气)已达平衡的是 A
A.混合气体的压强 B.混合气体的密度
C.B的物质的量浓度 D.混合气体的平均分子量
11.下列实验操作中错误的是: C
A. 分液时,分液漏斗中下层液体从下口放出,上层液体从上口倒出
B. 蒸馏时,温度计的水银球应靠近蒸烧瓶的支管口
C.中和滴定时,左手控制活塞,右手握持锥形瓶,眼睛注视滴定管中液面的变化
D.用托盘天平称量物体的质量时,物体放在左盘,砝码放在右盘
10.(NH4)2SO4在一定条件下发生如下反应:
4(NH4)2SO4=N2↑+6NH3↑+3SO2↑+SO3↑+7H2O
将反应后的混合气体通入足量的BaCl2溶液,产生的沉淀为 A
A.BaSO4 B.BaSO3 C.BaS D.BaSO4和BaSO3
9.已知NaHSO4在水中的电离方程式为:NaHSO4===Na++H++SO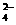 。某温度下,向pH=6的蒸馏水中加入NaHSO4晶体,保持温度不变,测得溶液的pH为2。下列对该溶液的叙述中,不正确的是 D
。某温度下,向pH=6的蒸馏水中加入NaHSO4晶体,保持温度不变,测得溶液的pH为2。下列对该溶液的叙述中,不正确的是 D
A.该温度高于25℃
B.由水电离出来的H+的浓度是1.0×10-10mol·L-1
C.NaHSO4晶体的加入抑制了水的电离
D.该温度下加入等体积pH为12的NaOH溶液可使该溶液恰好呈中性
8.强酸和强碱稀溶液的中和热表示为 H+(aq)+OH-(aq)=H2O(l) △H=-57.3kJ·mol-1
已知:① HCl(aq)+NH3·H2O(aq)=NH4Cl(aq)+H2O(l); △H=-a kJ·mol-1
② HCl(aq)+NaOH(s)=NaCl(aq)+H2O(l); △H=-b kJ·mol-1
③ HNO3(aq)+KOH(aq)=NaNO3(aq)+H2O(l); △H=-c kJ·mol-1
则a、b、c三者的大小关系为 B
A.a>b>c B.b>c>a C.a=b=c D.无法比较
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com