
题目列表(包括答案和解析)
28.(1)因为Mg2+能水解显弱酸性,加热时促进水解反应的进行, 生成更多的Mg(OH)2,而且加热蒸干时,Mg(OH)2还会分为MgO,从而得不到无水MgCl2,将MgCl2·6H2O;在HCl气氛中加热,可抑制水解,防止副反应发生而得到无水氯化镁。
(2)(1) ZnCl2·xH2O+xSOCl2=ZnCl2+xSO2+2xHCl
(2) 夺去ZnCl2·xH 2O中的水,同时生成HCl,它可以抑制ZnCl2的水解。
(3)
27.分子: 离子:
因为HCl和HClO的酸性所致;因为HClO的强氧化性所致
向上述刚好褪色的溶液中再滴入一些NaOH溶液,若红色重现,则是因为HCl和HClO的酸性所致;若红色不再重现,则是因为HClO的强氧化性所致。
26.(1)①把试纸用蒸馏水湿润 ② 检查容量瓶是否漏水
③用待装液润洗滴定管2-3次(也可以写:检查滴定管是否漏水)
④干燥集气瓶 ⑤ 调节零点
(2)③,2.4 ①,2.5
34.(6分)某温度下SO2的转化反应的平衡常数K =532.4,2SO2+O2  2SO3
2SO3
下面三个混合体系中各物质的浓度如下表:
|
体系 |
c(SO2) mol/L |
c(O2) mol/L |
c(SO3) mol/L |
反应方向 |
|
(1) |
0.0600 |
0.400 |
2.000 |
|
|
(2) |
0.0960 |
0.300 |
0.500 |
|
|
(3) |
0.0862 |
0.263 |
1.020 |
|
试判断各体系中反应进行的方向:
体系(1)
体系(2)
体系(3) 。
化学选修测试题(2006-11-08)参考作案
33.(8分)现有浓度为0.1 mol·L-1的五种电解质溶液:
①Na2CO3 ②NaHCO3 ③NaAlO2 ④CH3COONa ⑤NaOH,
已知:CO2+3H2O+2AlO2- 2Al(OH)3↓+CO32-
2Al(OH)3↓+CO32-
(1)这五种溶液的pH由小到大的顺序是____________________(填编号,下同);
(2)将五种溶液稀释相同的倍数时,其pH变化最大的是__________;
(3)在上述五种溶液中分别加入AlCl3溶液,能产生大量无色无味气体的是____;
(4)将上述①、②、③、④四种溶液两两混合时,有一对溶液相互间能发生反应,写出该反应的离子方程式______________________________________。
32.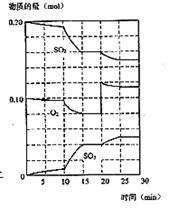 (10分)在一定条件下,二氧化碳和氧气发生如下反应:
(10分)在一定条件下,二氧化碳和氧气发生如下反应:
2SO2(g)+ O2 (g) 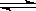 2SO3(g) ΔH<0
2SO3(g) ΔH<0
(1)写出该反应的化学平衡常数表达式
K=
(2)降低温度,该反应K值 ,二氧化碳转化率 ,化学反应速度 (以上均填“增大、减小或不变”)
(3)600℃时,在一密闭容器中,将二氧化碳和氧气混合,反应过程中SO2、O2、SO3物质的量变化如图,反应处于平衡状态的时间是 。
(4)据图判断,反应进行至20min时,曲线发生变化的原因是 (用文字表达)
(5)10min到15min的曲线变化的原因可能是 (填写编号)。
a.加了催化剂 b.缩小容器体积 c.降低温度 d.增加SO3的物质的量
31.(10分)
(1)(2分)有五瓶溶液分别是①10毫升0.60摩/升NaOH水溶液 ②20毫升0.50摩/升硫酸水溶液 ③30毫升0.40摩/升HCl溶液 ④40毫升0.30摩/升CH3COOH水溶液 ⑤50毫升0.20摩/升蔗糖水溶液。以上各瓶溶液所含离子、分子总数的大小顺序是___________________________________。
(2)(8分)25℃时,有pH=x的盐酸和pH=y 的氢氧化钠溶液(x≤6,y≥8),取aL该盐酸与该氢氧化钠溶液中和,消耗bL的氢氧化钠溶液,问:
①若x+y=14,则a/b=________________________(填数据);
②若x+y=13,则a/b=________________________(填数据);
③若x+y>14,则a/b=________________________(填表达式);
④该盐酸与该氢氧化钠溶液完全中和,两溶液的pH、x和y的关系式:
_________________________________________(填表达式)。
30.(10分)
(1) (3分) 下列各组热化学方程式中,化学反应的△H前者大于后者的是
①C(s)+O2(g)===CO2(g);△H1 C(s)+O2(g)===CO(g);△H2
②S(s)+O2(g)===SO2(g);△H3 S(g)+O2(g)===SO2(g);△H4
③H2(g)+O2(g)===H2O(l);△H5 2H2(g)+O2(g)===2H2O(l);△H6
④CaCO3(s)==CaO(s)+CO2(g);△H7 CaO(s)+H2O(l)==Ca(OH)2(s);△H8
(2) (3分)盖斯定律在生产和科学研究中有很重要的意义。有些反应的反应热虽然无法直接测得,但可通过间接的方法测定。现根据下列3个热化学反应方程式:
Fe2O3(s)+3CO(g)== 2Fe(s)+3CO2(g) △H= ―24.8kJ/mol
3Fe2O3(s)+ CO(g)==2Fe3O4(s)+ CO2(g) △H= ―47.2kJ/mol
Fe3O4(s)+CO(g)==3FeO(s)+CO2(g) △H= +640.5kJ/mol
写出CO气体还原FeO固体得到Fe固体和CO2气体的热化学反应方程式:
_________________
(3) (4分)有些盐的结晶水合物,白天在温度不太高时就能熔化(实质是溶于自身的结晶水中),同时吸收热量;在晚上又可缓慢凝固而释放热量,用以调节室温,称为潜热材料。现有几种盐的水合晶体有关数据如下:
|
|
Na2S2O3·5H2O |
CaCl2·6H2O |
Na2SO4·10H2O |
Na2HPO4·12H2O |
|
熔点(℃) |
40.50 |
29.92 |
32.38 |
35.1 |
|
熔化热(kJ/mol) |
49.7 |
37.3 |
77 |
100.1 |
①上述四种水合晶体盐中最适宜用做潜热材料的两种盐是(用化学式表示)
; 。
② 实际应用时最常采用的(由来源和成本考虑)应该是 。
29.(7分)火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态双氧水。当把0.4mol液态肼和0.8mol H2O2混合反应,生成氮气和水蒸气,放出256.7kJ的热量(相当于25℃、101 kPa下测得的热量)。
(1)反应的热化学方程式为 。
(2)又已知H2O(l)=H2O(g) ΔH=+44kJ/mol。则16g液态肼与液态双氧水反应生成液态水时放出的热量是 kJ。
(3)此反应用于火箭推进,除释放大量热和快速产生大量气体外,还有一个很大的优点是 。
28.(12分)
(1)工业上从海水中提取金属镁的反应如下:
Ca(OH)2+Mg2+ (海水中)=Mg(OH)2↓+Ca2+
Mg(OH)2+2HCl=MgCl2+H2O
MgCl2  Mg+Cl2↑
Mg+Cl2↑
在提取过程中,当氯化镁从溶液中析出时,得到的是MgCl2·6H2O。为制得无水氯化镁,工业上常将MgCl2·6H2O在HCl气氛中加热来制取。试解释其原因(用文字简要回答)
_____________________________________________________________________
_________________________________________________________________________________________________________________________________________。
(2).已知:ZnCl2·xH2O易溶于水,且其浓的水溶液呈较强酸性;SOCl2(氯化亚砜)极易和水发生如下反应:SOCl2+H2O=SO2+2HCl。实验室中制取无水氯化锌采用ZnCl2·xH2O与SOCl2混合加热的方法。 试回答:
①混合加热时发生反应的化学方程式是__________________________________;
②SOCl2的作用是_____________________________________________________。
(3)在少量Mg(OH)2悬浊液中,滴加适量饱和NH4Cl溶液,固体溶解。对于固体的溶解。 甲同学认为在氢氧化镁悬浊液中存在下列平衡:
Mg(OH)2 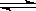 Mg2+ +2OH-
Mg2+ +2OH-
加入NH4Cl溶液,由于NH4+水解产生H+中和了Mg(OH)2电离产生的OH-而使平衡右移导致Mg(OH)2 溶解。而乙同学却认为NH4Cl电离产生的NH4+结合了OH-生成了弱电解质NH3·H2O,使c(OH-)减小,平衡右移而导致Mg(OH)2 溶解。设计方案说明问题:
_____________________________________________________________________
_________________________________________________________________________________________________________________________________________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com