
题目列表(包括答案和解析)
1].许多物质与身体健康有着密切关系,请结合所学知识,判断下列叙述中错误的是
A 缺镁易患心血管病,缺碘易患甲状腺肿大
B 在医疗上FeCl3常用作止血剂,ZnSO4常用作收敛剂
C 葡萄糖、食盐、味精均可作食品添加剂
D 苏丹红是一种呈红色的有机物,能当作辣椒红色素用于食品加工
28].(10分)天然有机物X具有光学活性(1个碳原子上有4个不同基团),既能与酸反应,也能与碱反应,但其其水溶液呈酸性;X与Cu(OH)2反应,生成电中性配合物分子Y;Y是弱电解质,水溶液中能电离出H+;Y分子中含有19.39%的Cu和29.31%的C。
通过计算和推理,确定X和Y的结构简式。
27].(8分)钙是人体神经、肌肉、骨骼系统、细胞膜和毛细血管通透性的功能正常运作所必需的常量元素,维生素D参与钙和磷的代谢作用,促进其吸收并对骨质的形成和改善有重要的作用。某制药有限公司生产的“钙尔奇D600片剂”的部分文字说明如下:“本品每片含主要成分碳酸钙1.5克(相当于钙元素600毫克),成人每天服用1片。”
(1)“1.5克碳酸钙与600毫克的钙”的计量关系是如何得出来的,请列式表示
(2)该公司的另一种产品,其主要成分与“钙尔奇D600”相同,仅仅是碳酸钙的含量不同。为测定该片剂中碳酸钙含量,某学生进行了如下的实验:取一片该片剂碾碎后放入足量的HCl中(假设该片剂的其余部分不与HCl反应)过滤,取滤液加(NH4)2C2O4,使Ca2+生成CaC2O4沉淀,沉淀过滤洗涤后溶解于强酸中,并稀释成1升溶液,取其20毫升,然后用0.01mol/L KMnO4 溶液滴定,反应中用去6毫升KMnO4溶液,发生的离子反应为:
MnO4―+H2C2O4+H+-2Mn2++CO2↑+H2O
① 请通过计算回答该片剂中碳酸钙的含量。
② 你认为该片剂的名称应该叫“钙尔奇D 片剂”。
26].(12分)有机物A是迄今为止国际公认的最好的防腐剂,无色针状结晶体,水溶液呈酸性。A分子中所有碳原子均共平面。A能发生臭氧化反应:①Zn还原得到等物质的量的3种产物(醛或酮);H2O2氧化得到物质的量为1︰2的2种产物(酸或酮)。A可由巴豆醛(CH3-CH=CH-CHO)和乙烯酮(CH2=C=O)为原料制备,得到中间产物δ-内酯B(六元环酯),再经水解即得A,A和B互为同分异构体。
(1)写出A的结构简式;
(2)写出A的臭氧化水解产物;
(3)写出制备A的2步反应方程式;
(4)A也可由巴豆醛和丙二酸通过2步反应制备,写出转化方程式;
(5)A也可由丁二烯、乙酸在醋酐、Mn3+存在下于140℃反应制备。
①Mn3+的作用是什么?
②该方法相对于题干方法的最大优势是什么?
24].(17分)
(1)正六价的高铁酸盐是一种强氧化剂。在酸性溶液中其氧化还原电极电位高达1.9V;在碱性溶液中其氧化还原电极电位也有0.9V。因此被广泛地用于代替高氯酸盐净化水和氧化生成有机化合物的反应。由高铁酸钡与锌组成的碱性干电池,其理论电压超过2.0V。分别写出上述3个反应(或半反应)的方程式。
(2)高铁酸钡可以电解法进行制备:以铂为阴极,铁为阳极,以饱和NaOH/Ba(OH)2溶液为电解液,以某阳离子交换膜为隔膜,此反应在惰性气体保护下进行。写出电极反应和总反应方程式;
(3)MnO2的掺入可降低高铁酸盐电池的放电电压,其机理是由于正极掺杂的MnO2也能发生放电反应,其放电产物Mn2O3可以与FeO42-发生化学反应,原来紫黑色粉末中开始出现铁锈色,生成的MnO2可以催化FeO42-发生还原反应,使得其还原电位向MnO2的还原电位靠拢,放电电压降低。请写出上面的所有反应式。
(4)高铁酸盐的浓度是通过铬酸盐氧化法进行确定的。在浓碱溶液中,过量的三价铬盐定量还原高铁酸盐而自身被氧化为铬酸盐(CrO42-),所生成的铬酸盐经酸化变为重铬酸盐(Cr2O72-),再用标准的Fe2+溶液滴定。
(1)写出上述反应方程式;
(2)指出FeO42-与Fe2+的计量关系。
23].(7分)2000年美国《科学》杂志报道,意大利科学家合成了一种新型氧分子,它是由4个氧原子构成的O4分子。O4分子的结构如右图所示。
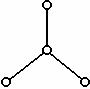 (1)判断O4分子是否是极性分子
(1)判断O4分子是否是极性分子
(2)判断O4固体的晶体类型
(3)可燃物在O4中燃烧比在O2中燃烧释放的热量大还是小,为什么?
(4)O4具有强氧化性,能将Fe2+氧化为Fe3+,试配平:
O4+ Fe2++ → Fe3++ H2O+ O2
在该反应中,当生成1 mol O2,转移电子的物质的量为________mol。
21].(10分)某课外兴趣小组对双氧水(H2O2水溶液)做了如下实验探究。
(1)将质量相同但聚集状态不同的MnO2分别加入5mL 5%的双氧水中,并用带火星的木条试之。测定结果如下:
|
催化剂(MnO2) |
操作情况 |
观察结果 |
反应完成所需的时间 |
|
粉末状 |
混合不振荡 |
剧烈反应,使木条复燃 |
3.5分钟 |
|
块状 |
|
反应较慢,火星红亮但木条未复燃 |
30分钟 |
①写出H2O2反应的化学方程式 。
②实验结果说明催化剂作用的大小与 有关。
(2)取三份含有等量H2O2,但质量分数不同的双氧水,分别向其中加入1克MnO2粉末。测定结果如下:
|
双氧水体积 |
操作情况 |
反应完成所需的时间 |
收集到气体体积 |
反应后液体温度 |
|
a1%的150mL |
|
11分钟 |
539mL |
24℃ |
|
a2%的15mL |
混合不振荡 |
1分20秒 |
553mL |
56℃ |
|
a3%的7.5mL |
|
9秒 |
562mL |
67℃ |
请简要说明:
①反应完成所需的时间不同的原因 。
②反应后液体温度不同的原因 。
③收集到气体体积不同的原因 。
(3)向含有酚酞的NaOH稀溶液中,逐滴滴入10%的双氧水,红色褪去。
①已知双氧水显弱酸性,试写出H2O2的电离方程式: 。
②小组讨论红色褪去的原因时,甲同学认为是双氧水显酸性所致;乙同学认为是双氧水有较强氧化性所致。请你设计一个简单实验来说明是甲对还是乙对。(简要文字说明)
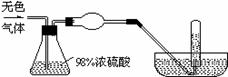 [22].(9分)有一无色气体(可能由O2、N2、CO2、HCl、NH3、H2、NO、NO2中的一种或几种组成),体积为100mL。如图示通过浓硫酸的洗气瓶,发现气体体积减少到一半;通过球形干燥管后气体呈红棕色,再将该气体完全通入盛满水且倒立于水槽的试管内,发现倒立于水槽的试管内的水位下降后又缓慢上升,最后试管内全部充满液体,由此判断:
[22].(9分)有一无色气体(可能由O2、N2、CO2、HCl、NH3、H2、NO、NO2中的一种或几种组成),体积为100mL。如图示通过浓硫酸的洗气瓶,发现气体体积减少到一半;通过球形干燥管后气体呈红棕色,再将该气体完全通入盛满水且倒立于水槽的试管内,发现倒立于水槽的试管内的水位下降后又缓慢上升,最后试管内全部充满液体,由此判断:
(1)球形干燥管内的固体是 ,反应方程式为 ;
(2)原气体中一定有 ,其体积分别是 ;
(3)原气体中一定没有 。
20].相同容积的四个密闭容器中进行同样的可逆反应:2X(g)+Y(g) 3W(g)+2Z(g)
3W(g)+2Z(g)
起始时四个容器所装X、Y的量分别为:
甲(X:2mol,Y:1mol) 乙(X:1mol,Y:1mol) 丙(X:2mol,Y:2mol) 丁(X:1mol,Y:2mol)
在相同温度下,建立平衡时,X或Y的转化率大小关系为
A X的转化率为:甲<丙<乙<丁 B X的转化率为:甲<乙<丙<丁
C Y的转化率为:甲>丙>乙>丁 D Y的转化率为:丁>乙>丙>甲
|
一 |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
二 |
11 |
12 |
13 |
14 |
15 |
16 |
17 |
18 |
19 |
20 |
|
|
|
|
|
|
|
|
|
|
|
|
19].氢化亚铜(CuH)是一种难溶物质,用CuSO4溶液和“另一种反应物”在40℃-50℃时反应可生成它,CuH不稳定,CuH在氯气中能燃烧;跟盐酸反应能产生气体。以下有关它的推断错误的是
A 这“另一种反应物”一定具有氧化性 B CuH既可做氧化剂也可做还原剂
C CuH+Cl2=CuCl+HCl(燃烧) D 2CuH+2HCl=CuCl2+2H2↑+Cu(常温)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com