
题目列表(包括答案和解析)
4].利用下列各组物质制备和收集相应的气体,适宜采用右图所示装置的有下述5个制备实验中的:①电石和水;②MnO2和浓盐酸;③Cu和稀硝酸;④Na2SO3和硫酸;⑤浓盐酸和浓硫酸
A 1个 B 2个 C 3个 D 4个
3].六氧化四磷的分子结构中只含有单键,且每个原子的最外层都满足8电子结构,则该分子中含有的共价键的数目是
 A 10 B 12 C 24 D 28
A 10 B 12 C 24 D 28
2].工业上冶炼金属一般用热分解法、热还原法和电解法。不同的金属应选用不同的冶炼方法。你认为选择的原则主要是依据
A 金属在自然界的存在形式 B 金属熔点的高低
C 金属离子得电子的能力 D 金属元素在地壳中的含量
1].利用新技术能将不锈钢加工成为柔软的金属丝,它和棉纤维一起编织成为防辐射的劳防服装,这是利用了金属的
A 耐腐蚀性 B 还原性 C 热传导性 D 延展性
28].(10分)少量的碘化物可利用“化学放大”反应进行测定,其步骤如下:在中性或弱酸性介质中先用Br2将试样中I-定量氧化成碘酸盐,除去过量的Br2,然后加入过量的KI,用CCl4萃取生成的I2(萃取率E=100%)。分去水相后,用肼(即联氨)的水溶液将I2反萃取至水相。再用过量的Br2氧化,除去剩余Br2后加入过量KI,酸化,淀粉作指示剂,用Na2S2O3标准溶液滴定(I2+2S2O32-=2I-+S2O42-),求得I-的含量。
(1)写出上述过程的离子反应式。
(2)上述步骤中2次除去过量Br2的实验方法是什么?
(3)根据有关反应的化学计量关系,说明经上述步骤后,试样中I-相当于“放大”到多少倍(1mol I-消耗多少mol Na2S2O3)?
(4)若在测定时,准确移取含KI的试液25.00mL,终点时耗用0.100mol/L Na2S2O3 20.06mL,请计算试液中KI的含量(g/L)。
27].(6分)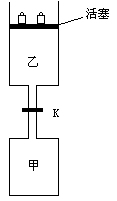 如图所示,当关闭阀门K时,向甲中充入1.5mol A、3.5mol B,向乙中充入3mol A、7mol B,起始时,甲、乙体积均为VL。在相同温度和有催化剂存在的条件下,两容器中各自发生下列反应:
如图所示,当关闭阀门K时,向甲中充入1.5mol A、3.5mol B,向乙中充入3mol A、7mol B,起始时,甲、乙体积均为VL。在相同温度和有催化剂存在的条件下,两容器中各自发生下列反应:
3A(g)+2B(g) C(g)+2D(g);ΔH<0
C(g)+2D(g);ΔH<0
达到平衡(Ⅰ)时,V(乙)=0.86V L。请回答:
(1)乙中B的转化率为 ;
(2)甲中D和乙中C的物质的量比较:
(填“相等”、“前者大”、“后者大”);
(3)打开K,过一段时间重新达平衡(Ⅱ)时,乙的体积为
(用含V的代数式表示,连通管中气体体积忽略不计)
26].(10分)某饱和脂肪环烃X只有伯(-CH3)、季( )两类碳原子组成,其个数比是8︰5;X分子具有很好的空间对称性,一氯取代物只有2种;经测定其一氯代物的Cl元素含量约为9%。
)两类碳原子组成,其个数比是8︰5;X分子具有很好的空间对称性,一氯取代物只有2种;经测定其一氯代物的Cl元素含量约为9%。
(1)确定X的最简式和化学式;
(2)画出的结构式,说明理由;
(3)确定X的二氯取代物种数(不考虑立体异构)。
25].(11分)3,4-二氨基苯乙酸(E)是重要的药物中间体,其合成路线如下:
A(C8H9NO2) B
B C
C D
D E
E
(1)写出A-E各物质的结构简式;
(2)写出A→B、D→E的化学反应方程式。
(3)①第二步反应往B中需慢慢滴加混酸,为什么?
②联合使用第一、三步反应的作用是什么?
⑤最后一步产品在pH=5时最易析出,为什么?
24].(13分)发射“神舟”飞船的长征火箭用了肼(N2H4)作燃料,N2H4与NH3有相似的化学性质。
(1)写出肼的电子式 ;
(2)写出肼与盐酸反应的离子方程式 。
(3)用拉席希法制备肼,是将NaClO和NH3反应生成肼,试写出该反应的化学方程式
。
(4)在火箭推进器中装有强还原剂肼和强氧化剂双氧水,当它们混合时,即产生大量气体,并放出大量热。已知12.8g液态肼与足量液态双氧水反应生成氮气和水蒸气,放出256.65kJ的热量;1mol液态水变成1mol水蒸气需要吸收44kJ的热量。写出热化学方程式
。
(5)通常人们把拆开1mol某化学键所吸收的能量看成该化学键的键能。
|
化学键 |
N-H |
N-N |
O=O |
N≡N |
O-H |
|
键能/KJ·mol-1 |
386 |
167 |
498 |
946 |
460 |
发射火箭时肼(N2H4)为燃料,若在O2(气态)中燃烧,生成N2(气态)和H2O(液态)。写出热化学方程式 。
(6)发射火箭时肼(N2H4)为燃料,也可以二氧化氮或氟气作氧化剂,分别写出化学方程式: 、 。
(7)对比O2、F2、H2O2、NO2四种助燃剂,放出热量最多时应选用 ;实际我们选用的助燃剂是NO2,主要考虑的因素是 。
(8)“神州六号”飞船外壳使用了一种新型陶瓷结构材料,主要成分是氮化硅,是一种超硬物质,耐磨损、耐高温。请推测氮化硅的化学式为: ,氮化硅晶体类型是 ;晶体中存在的化学键是 。
23].(9分)已知B、D、E是单质。根据下列关系,试回答:
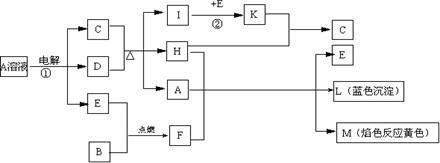
(1)写出下列物质的化学式
A: 、L: 、M ;
(2)F的电子式: ;K的空间构型是 ;
(3)反应①的离子方程式: 。
(4)反应②工业上采取的反应条件: ;原料是否需要进行循环生产: 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com