
题目列表(包括答案和解析)
25].(10分)A-J、a、b分别代表十种不同的有机物。它们之间的相互转化关系如下图:

(1)A的结构式为 ;F的结构简式为 ;指出C→G的反应类型 。
(2)写出下列转化的化学方程式
①C→D
②G→H
(3)写出与有机物I互为同分异构体,且结构中含有羧基和羟基的有机物共 种。
(4)作为隐形眼镜的材料,应该具有良好的透气性和亲水性,请从H的结构上分析它可以作为隐形眼镜材料的原因 。
24].(10分)各地电视台的天气预报中都要预报城市的空气质量。根据国家环保局的统一规定,目前进行常规大气监测的项目是:二氧化硫、氮氧化合物、悬浮颗粒物等三种大气污染物。
 (1)解放日报2004年10月14日报道:德国科学家日前利用卫星数据和一种先进的仪器,绘制了一幅地球上空二氧化氮的分布图,从科学家绘制的二氧化氮分布图看,欧洲和北美洲的一些大城市上空二氧化氮密度很高,其原因是什么?
(1)解放日报2004年10月14日报道:德国科学家日前利用卫星数据和一种先进的仪器,绘制了一幅地球上空二氧化氮的分布图,从科学家绘制的二氧化氮分布图看,欧洲和北美洲的一些大城市上空二氧化氮密度很高,其原因是什么?
(2)与氮氧化合物有关的全球或区域性大气环境问题主要有哪些?
(3)静电除尘是治理悬浮颗粒污染的方法之一,右图为静电除尘器的示意图。已知A接高压电源正极,B接在高压电源负极,空气分子能被强电场电离为电子和正离子。请结合图具体说明静电除尘原理。
(4)用KIO3-淀粉溶液可定性检验空气中的SO2,写出反应方程式。
(5)高锰酸钾法可定量测定空气中的SO2含量:反应器中有25.00mL 0.0200mol/L的KMnO4(H+)溶液,往其中持续缓缓通入5.00m3空气,结束后,用0.1000mol/L标准 (NH4)2Fe(SO4)2溶液滴定过量KMnO4溶液至无色,消耗22.48mL。计算空气中SO2的含量(mg/m3)
23].(10分)已知A为常见金属,X、Y为常见非金属,X、E、F、G常温下为气体,C为液体,B是一种在工农业生产中用途较广的盐。现用A与石墨作电极,B的浓溶液作电解质,构成原电池。有关物质之间的转化关系如下图(注意:其中有些反应的条件及部分生成物被略去):
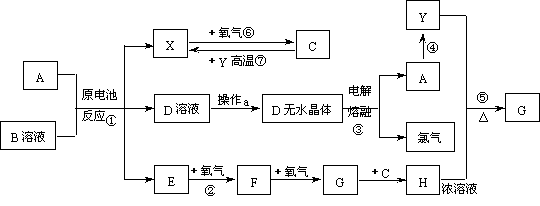
请填写下列空白:
(1)反应④为A在某种气体中燃烧,生成单质Y和A的氧化物,其反应方程式为
。
(2)从D溶液制备D的无水晶体的“操作a”为 。
(3)反应②的化学方程式为 。
(4)反应⑤的化学方程式为 。
(5)原电池反应①中正极的电极反应式为 。
22].(9分)某工厂的废水中含有FeSO4、H2SO4、Ag2SO4、Al2(SO4)3及一些污泥。某研究性学习课题组拟利用该厂的废铁屑(含少量锈斑)以及烧碱和硫酸处理此污水,并回收FeSO4·7H2O和Ag。参考数据如下:
表一 废水中各物质的含量
|
物质 |
FeSO4 |
H2SO4 |
Ag2SO4 |
Al2(SO4)3 |
污泥 |
|
质量分数(%) |
15.0 |
7.0 |
0.40 |
0.34 |
5.0 |
表二 FeSO4和Al2(SO4)3在水中的溶解度
|
温度(℃) |
0 |
10 |
20 |
30 |
40 |
50 |
|
FeSO4(g) |
15.6 |
20.5 |
26.5 |
32.9 |
40.2 |
48.6 |
|
Al2(SO4)3 |
31.2 |
33.5 |
36.4 |
40.4 |
45.7 |
52.2 |
(1)用简明的文字续写实验步骤:
①将带有锈斑的废铁屑先后用热的烧碱溶液和热水进行洗涤;
②
③
④
⑤
(2)写出处理好的铁屑在实验中发生的全部反应方程式。
21].(11分)某课外活动小组设计了以下实验方案验证Ag与浓硝酸反应的过程中可能产生NO。其实验流程图如下:

 (1)测定硝酸的物质的量
(1)测定硝酸的物质的量
反应结束后,从下图B装置中所得100mL溶液中取出25.00mL溶液,用0.1mol·L-1的NaOH溶液滴定,用酚酞作指示剂,滴定前后的滴定管中液面的位置如图所示。在B容器中生成硝酸的物质的量为 。
 (2)测定NO的体积
(2)测定NO的体积
①从上图所示的装置中,你认为应选用 装置进行Ag与浓硝酸反应实验,选用的理由是
。
②选用如上图所示仪器组合一套可用来测定生成NO体积的装置,其合理的连接顺序是 (填各导管口编号)。
③在测定NO的体积时,若量筒中水的液面比集气瓶的液面要低,此时应将量筒的位置_______(“下降”或“升高”),以保证量筒中的液面与集气瓶中的液面持平。
(3)气体成份分析
若实验测得NO的体积为93.0mL(已折算到标准状况),则Ag与浓硝酸反应过程中
(填“有”或“没有”)NO产生,作此判断的依据是 。
|
一 |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
二 |
11 |
12 |
13 |
14 |
15 |
16 |
17 |
18 |
19 |
20 |
|
|
|
|
|
|
|
|
|
|
|
|
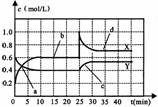 [19].已知NO2和N2O4可以相互转化:2NO2
[19].已知NO2和N2O4可以相互转化:2NO2 N2O4(正反应为放热反应)。现将一定量NO2和N2O4的混合气体通入一体积为1L的恒温密闭容器中,反应物浓度随时间变化关系如右图所示。下列说法错误的是
N2O4(正反应为放热反应)。现将一定量NO2和N2O4的混合气体通入一体积为1L的恒温密闭容器中,反应物浓度随时间变化关系如右图所示。下列说法错误的是
A 图中共有两条曲线X和Y,其中曲线X表示NO2浓度随时间的变化
B a、b、c、d四个点中,表示化学反应处于平衡状态的点是b和d
C 反应进行至25min时,曲线发生变化的原因是加入0.2mol N2O4
D 若要达到与最后相同的化学平衡状态,在25min时还可以采取的措施是适当缩小容器体积
20].现有两种不含结晶水的盐,它们在不同温度下的溶解度分别是:
|
温度 |
20℃ |
50℃ |
|
A的溶解度 |
35.7g |
46.4g |
|
B的溶解度 |
31.6g |
108g |
下列说法中,正确的是
A 两种盐在某一温度下具有相同的溶解度
B 可采用重结晶法使A、B混合物分离
C 在20℃时,A、B都可以配成溶质质量分数为25%的不饱和溶液
D 若把108g B的饱和溶液从50℃降到20℃,析出的B是76.4g
18].工业上进行下列物质的制取,其所示的物质的转化关系中,正确的是
A 以食盐为原料制Na2CO3:2NaCl+2H2O 2NaOH+H2↑+Cl2↑;2NaOH+CO2=Na2CO3+H2O
2NaOH+H2↑+Cl2↑;2NaOH+CO2=Na2CO3+H2O
B 以铜和硫酸为原料制取硫酸铜:2Cu+O2 2CuO CuO+H2SO4=CuSO4+H2O
2CuO CuO+H2SO4=CuSO4+H2O
C 从海水中提取MgCl2:MgCl2+2NaOH=Mg(OH)2↓+2NaCl Mg(OH)2+2HCl=MgCl2+H2O
D 黄铁矿为原料制硫酸:4FeS+7O2 2Fe2O3+4SO2;2SO2+O2
2Fe2O3+4SO2;2SO2+O2 2SO3;SO3+H2O=H2SO4
2SO3;SO3+H2O=H2SO4
高二化学竞赛联考题(四)
(时间:120分钟 满分:150分)
班级: 姓名:
|
H 1.008 |
相对原子质量 |
He 4.003 |
|||||||||||||||
|
Li 6.941 |
Be 9.012 |
|
B 10.81 |
C 12.01 |
N 14.01 |
O 16.00 |
F 19.00 |
Ne 20.18 |
|||||||||
|
Na 22.99 |
Mg 24.31 |
Al 26.98 |
Si 28.09 |
P 30.97 |
S 32.07 |
Cl 35.45 |
Ar 39.95 |
||||||||||
|
K 39.10 |
Ca 40.08 |
Sc 44.96 |
Ti 47.88 |
V 50.94 |
Cr 52.00 |
Mn 54.94 |
Fe 55.85 |
Co 58.93 |
Ni 58.69 |
Cu 63.55 |
Zn 65.39 |
Ga 69.72 |
Ge 72.61 |
As 74.92 |
Se 78.96 |
Br 79.90 |
Kr 83.80 |
|
Rb 85.47 |
Sr 87.62 |
Y 88.91 |
Zr 91.22 |
Nb 92.91 |
Mo 95.94 |
Tc [98] |
Ru 101.1 |
Rh 102.9 |
Pd 106.4 |
Ag 107.9 |
Cd 112.4 |
In 114.8 |
Sn 118.7 |
Sb 121.8 |
Te 127.6 |
I 126.9 |
Xe 131.3 |
|
Cs 132.9 |
Ba 137.3 |
La-Lu |
Hf 178.5 |
Ta 180.9 |
W 183.8 |
Re 186.2 |
Os 190.2 |
Ir 192.2 |
Pt 195.1 |
Au 197.0 |
Hg 200.6 |
Tl 204.4 |
Pb 207.2 |
Bi 209.0 |
Po [210] |
At [210] |
Rn [222] |
|
Fr [223] |
Ra [226] |
Ac-La |
Rf |
Db |
Sg |
Bh |
Hs |
Mt |
Ds |
|
|
La系 |
La 138.9 |
Ce 140.1 |
Pr 140.9 |
Nd 144.2 |
Pm 144.9 |
Sm 150.4 |
Eu 152.0 |
Gd 157.3 |
Tb 158.9 |
Dy 162.5 |
Ho 164.9 |
Er 167.3 |
Tm 168.9 |
Tb 173.0 |
Lu 175.0 |
|
Ac系 |
Ac 227.0 |
Th 232.0 |
Pa 231.0 |
U 238.0 |
Np [237] |
Pu [244] |
Am [243] |
Cm [247] |
Bk [247] |
Cf [251] |
Es [252] |
Fm [257] |
Md [258] |
No [259] |
Lr [262] |
17].为提纯下列物质(括号内为杂质),所选用的试剂和分离方法均正确的是
|
选项 |
被提纯的物质 |
除杂试剂 |
分离方法 |
|
A |
溴乙烷(乙醇) |
水 |
分液 |
|
B |
氯化铵溶液(氯化铁) |
NaOH |
过滤 |
|
C |
硝酸铜溶液(硝酸银) |
铜粉 |
结晶 |
|
D |
二氧化碳(二氧化硫) |
饱和NaHCO3溶液 |
洗气 |
16].中学化学教材中有大量数据,下列为某同学对数据的利用情况,其中不正确的是
A 用NaOH和HCl反应测得的中和热,推算一定量稀H2SO4和NaOH 溶液反应的反应热
B 用沸点数据推测两种液体混合物用蒸馏方法分离开来的可能性
C 用熔沸点数据来分析分子的稳定性
D 用原子(或离子)半径数据推断某些原子(或离子)氧化性或还原性强弱
15].莽草酸是从中药八角茴香中提取的一种单体化合物,有抗炎、镇痛等作用,也是我国人民的烹调香料,尤其是目前全国各地众志成城、严防死守禽流感疫情的关键时期,莽草酸是禽流感唯一特效药“达菲” 生产过程中的关键原材料,莽草酸的结构如右图。关于莽草酸的叙述正确的是
A 可以与溴水发生取代反应,又能发生加成反应
B 1mol该物质可以和4mol NaOH反应
C 结构中三个羟基在同一平面上
D 该物质在一定条件下能发生消去反应
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com