
题目列表(包括答案和解析)
4].硫酸铜遇到黄铁矿(FeS2)可以发生反应:CuSO4+FeS2+H2O - Cu2S+FeSO4+H2SO4,在该反应中,被氧化的硫原子与被还原的硫原子的物质的量之比为
A 7︰3 B 3︰7 C 7︰5 D 5︰7
 [5].慈溪中学某研究性学习小组在施老师指导下做了一个如图所示的实验,发现烧杯中酸性KMnO4溶液褪色。若将烧杯中的溶液换成含有少量KSCN的FeCl2溶液,溶液显红色。判断下列说法中正确的是
[5].慈溪中学某研究性学习小组在施老师指导下做了一个如图所示的实验,发现烧杯中酸性KMnO4溶液褪色。若将烧杯中的溶液换成含有少量KSCN的FeCl2溶液,溶液显红色。判断下列说法中正确的是
A 该条件下生成的水分子化学性质比较活泼
B 该条件下H2被冷却为液态氢,液氢的水溶液具有还原性
C 该条件下H2燃烧生成了具有还原性的物质
D 该条件下H2燃烧的产物中可能含有一定量的H2O2
3].金属铝与稀盐酸发生反应,生成氯化铝和氢气。从反应类型的角度分析,该反应属于下面:①置换反应 ②氧化还原反应 ③离子反应 ④取代反应 ⑤放热反应 ⑥复分解反应 中的几个
A 3个 B 4个 C 5个 D 6个
2].四氯乙烯对环境有一定的危害,干洗衣服的干洗剂主要成分是四氯乙烯;家用不粘锅内侧涂覆物质的主要成分是聚四氟乙烯。下列关于四氯乙烯和聚四氟乙烯的叙述中正确的是
A 它们都属于纯净物 B 它们的分子中都不含氢原子
C 它们都能使酸性高锰酸钾溶液褪色 D 它们都可由乙烯只发生加成反应得到
1].宇航员在升空、返回或遇到紧急情况时,必须穿上10公斤重的舱内航天服,神六宇航员所穿舱内航天服是我国科学家近年来研制的新型“连续纤维增韧”航空材料做成,其主要成风是由碳化硅、陶瓷和碳纤维复合而成的,下列相关叙述错误的是
A 它耐高温,抗氧化 B 它比钢铁轻、硬,但质地较脆
C 它没有固定熔点 D 它是一种新型无机非金属材料
28].有一瓶由K2FeO4和K2Cr2O7组成的混合溶液,通过下面的实验确定其浓度。取混合溶液20.00mL于锥形瓶中,加入14.00g (NH4)2Fe(SO4)2·6H2O晶体和适量硫酸,充分反应后,滴加0.0240mol/L的KMnO4溶液,至溶液显紫色时消耗23.38mL。另取混合溶液10.00mL于锥形瓶中,加等体积水稀释,加入过量KI固体,以淀粉溶液为指示剂,滴加0.8000mol/L的Na2S2O3溶液(I2+2Na2S2O3=Na2S4O6+2NaI),终点时消耗24.06mL。计算原溶液中K2FeO4和K2Cr2O7的浓度(已知上述2个K2Cr2O7参与的反应中还原产物都是Cr3+)。
27].(9分)铝是国民经济发展的重要材料,铝在地壳中含量约占8%,目前我国铝消费超过430万吨,在众多的金属中仅次于钢铁。试完成(1)、(2)两小题
(1)实验室中用金属铝制备少量氢氧化铝,有以下3种方案
方案1:Al→Al3+→Al(OH)3
方案2:Al→AlO2-→Al(OH)3
|
方案3: |
Al→Al2(SO4)3 |
 →Al(OH)3 →Al(OH)3 |
|
Al→NaAlO2 |
制备相同物质的量的氢氧化铝消耗酸和碱最少的方案是 ;按最优方案,每制备1molAl(OH)3,至少消耗3mol/LH2SO4溶液 mL,6mol/LNaOH溶液 mL。
(2)工业上制取铝的流程图如下:

在制取氧化铝中,分析铝土矿和赤泥所得数据如下:
|
|
Al2O3 |
Fe2O3 |
NaOH |
其它杂质 |
|
铝土矿 |
55% |
16% |
0 |
/ |
|
赤泥 |
15% |
48% |
8% |
/ |
设杂质不参加反应,则每生产a吨纯净氧化铝,需铝土矿多少吨?投入的烧碱固体多少吨?
26].(16分)2005年8月8日晚,广州天河区一辆载十几吨高毒化学品的货柜车发生交通事故,导致巯基乙酸发生泄漏。巯基乙酸(A,HSCH2COOH)是无色液体,伴有特异臭味,可与水和醇、醚、苯等有机溶剂以任何比例混合;A易被空气氧化为B,经检测B分子中存在S-S键。巯基乙酸是种重要的且应用广泛的精细化工产品,一般以氯乙酸钠为原料,可由多种方法合成。
(1)写出B的结构简式 ;
(2)用硫氢化钾同氯乙酸钠反应合成巯基乙酸(钠),写出合成反应方程式;该合成中可能产生哪2种副产物?
(3)硫脲法是是生产巯基乙酸的主要方法,其合成方法如下:用物料比氯乙酸钠∶硫脲(SC(NH2)2)=1∶1,加热搅拌反应30min后得E;用氢氧化钡在95℃水解120min,得到A的钡盐、尿素和氯化钠;再经酸化即得A。经检测E分子中不存在C=S键。写出前2步反应方程式。
(4)用氯乙酸钠和硫代硫酸钠为原料,两步法(成盐、水解)合成了巯基乙酸钠。写出反应方程式。
(5)碘量法可测定巯基乙酸的含量,写出实验原理。
25].(7分)一种用于治疗高血脂的新药灭脂灵可按如下路线合成:

已知:
(1)写出B、E的结构简式:B ,E 。
(2)反应①-⑤中属于取代反应的有 。
(3)反应②方程式为 。
(4)反应⑤方程式为 。
 [23].(10分)A、B、C、D、E、F六种物质的相互转化关系如右图所示(反应条件未标出),其中反应①是置换反应。
[23].(10分)A、B、C、D、E、F六种物质的相互转化关系如右图所示(反应条件未标出),其中反应①是置换反应。
(1)若A、D、F都是非金属单质,且A、D所含元素同主族,A、F所含元素同周期,则反应①的化学方程式是
。
(2)若A是常见的金属单质,D、F是气态单质,反应①在水溶液中进行,则反应②(在水溶液中进行)的离子方程式是 ;已知1 g D与F反应生成B时放出92.3 kJ热量,写出该反应的热化学方程式 。
(3)若B、C、F都是气态单质,且B有毒,③和④两个反应中都有水生成,反应②需要一定条件才能发生,A、D相遇有白烟生成,则C的电子式是 ,反应③的化学方程式是 。
(4)若A、D为短周期元素单质,且所含元素的原子序数A是D的2倍,所含元素的原子核外最外层电子数D是A的2倍,③和④两个反应中都有颜色气体生成,B的结构式是 ,反应④的化学方程式是 。
24].(10分)氧化镍是一种很有前途的材料,它被广泛应用在催化剂、电极等方面。最新液相合成路线如下:将硝酸镍(Ni(NO3)2·6H2O)和草酸(H2C2O4)分别溶于乙醇中配制成溶液,在不断搅拌硝酸镍溶液的过程中将草酸溶液逐渐转移到上述溶液中,最终生成浅蓝色沉淀,然后将沉淀过滤,在室温下干燥得到浅蓝色前驱体A,将A在700℃煅烧得到黑色的纳米氧化镍粉体(失重59.1%)。
(1)写出A的化学式 ;
(2)写出合成A和A分解为氧化镍的化学方程式;
(3)本实验以乙醇为溶剂比与水为溶剂制备有什么优点?
(4)比表面积S(m2/g)是评价纳米材料的重要参数之一(纳米粒子按球形计)。
①写出比表面积S和粒子直径D(nm)、密度ρ(g/cm3)的关系式: ;
②已知氧化镍的密度为6.67g/cm3;该纳米粒子的直径为8.0nm,计算其比表面积: 。
 [21].(5分)在Inorganic
Syntheses一书中,有一装置是用以制备某种干燥的纯净气体,如下图所示:其A中应盛放一种密度比B中密度小的液体。下表中为几种液体的密度
[21].(5分)在Inorganic
Syntheses一书中,有一装置是用以制备某种干燥的纯净气体,如下图所示:其A中应盛放一种密度比B中密度小的液体。下表中为几种液体的密度
|
溶液名称 |
浓盐酸 |
浓硫酸 |
浓氨水 |
浓氢氧化钠溶液 |
浓醋酸 |
|
密度(g/mL) |
1.19 |
1.84 |
0.89 |
1.41 |
1.06 |
现从上述液体中选出几种适宜的试剂来利用该装置制出干燥纯净气体.
(1)制备出的气体其化学式是 。(写出全部可以制备的气体)
(2)应选用的试剂:A中盛 ;B中盛 。(任写一组)
(3)装置中毛细管的作用是 。
22].(12分)二氯化硫(SCl2)熔点-78℃,沸点59℃。密度1.638。遇水易分解。SCl2与SO3作用可生成重要化工试剂亚硫酰氯(SOCl2)。以下是由氯气与硫反应合成二氯化硫的实验装置。
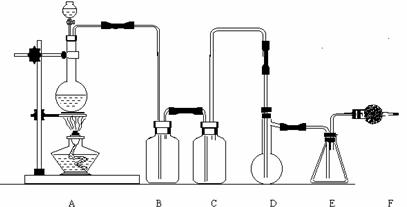
(1)装置A中发生反应的化学方程式为 。
(2)装置B盛放的药品是 ;C中是 。
(3)实验开始前先在D中放入一定量的硫粉,加热使硫熔化,然后转动和摇动烧瓶使硫附着在烧瓶内壁形成一薄层表面,这样做的目的是 。
(4)实验时,D装置需加热至50-59℃,最好采用何种方式 加热。如何防止E中液体挥发 。
(5)F装置中干燥管内所盛物质是 ,作用是 。
(6)二氯化硫电子式为 ;由二氯化硫与SO3作用生成亚硫酰氯的化学方程式为 。
(7)亚硫酰极易水解,也能与乙醇等有机试剂反应,写出上述反应方程式 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com