
题目列表(包括答案和解析)
8].为验证人体呼出气体中含有的CO2不是来自空气,而是人体代谢作用产生的。某学校学生课外活动小组设计了如下图所示装置,你认为该装置应选用的试剂是
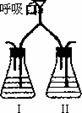 A Ca(OH)2 NaOH B NaOH Ca(OH)2
A Ca(OH)2 NaOH B NaOH Ca(OH)2
C 稀HCl Ca(OH)2 D NaOH BaCl2
7].对可逆反应4NH3(g)+5O2(g)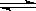 4NO(g)+6H2O(g),下列叙述正确的是
4NO(g)+6H2O(g),下列叙述正确的是
A 达到化学平衡时,4v正(O2)=5v逆(NO)
B 若单位时间内生成x mol NO的同时,消耗x mol NH3,则反应达到平衡状态
C 达到化学平衡时,若增加容器体积,则正反应速率减小,逆反应速率增大
D 达到化学平衡时,若升高温度,NO的体积分数减小,则正反应是吸热反应
6].以共价单键相连的非金属单质中,1个原子与相邻原子成键的数目为8-N个,N为该非金属元素的族序数,这一现象化学家称为8-N规则。某非金属单质结构如图所示,构成该单质的元素位于:
A ⅢA B ⅣA C ⅤA D ⅥA
5].有人建议将氢元素排在元素周期表的ⅦA。下列事实能支持这一观点的有
①氢原子得到一个电子实现最外层稳定结构 ②氢分子的结构式为H-H ③与碱金属元素形成离子化合物MH ④单质分子中原子间的化学键属于非极性键
A 1句 B 2句 C 3句 D 4句
4].为确定下列置于空气中的物质是否变质,所选检验试剂(括号内物质)不能达到目的的是
A NaOH溶液(Ba(OH)2溶液) B FeSO4溶液(KSCN溶液)
C KI(淀粉溶液) D Na2SO3溶液(BaCl2溶液)
3].欧洲科学家小组将62Ni和208Pb经核聚合并紧接着释放出一个中子而产生了第110号元素的一种同位素,该同位素的中子数是
A 161 B 160 C 159 D 158
2].绿色化学的着眼点是使污染消灭在生产源头,使整个生产过程对环境友好。下列叙述中违背绿色化学含义的是
A 研制新的杀虫剂,使它只对目标昆虫有毒杀作用,并能通过生物降解变为无毒物质
B 使用生物制品(如用生物发酵法制乙醇)取代石油化工原料
C 生产出可用水代替有机溶剂的化工涂料
D 大量用聚苯乙烯等塑料代替木材生产包装盒、快餐盒等,以减少木材使用,保护森林
1].我国继启动了食盐补碘工程之后,今年又启动了补铁工程。我国补铁工程的载体主要是
A 食盐 B 淀粉 C 酱油 D 食油
28].Na2S2O3·5H2O(俗称海波)是照相业常用的一种定影剂。工业上制得的Na2S2O3·5H2O晶体中可能含有少量的Na2SO4杂质。为了测定某海波样品的成分,称取三份质量不同的该样品,分别加入相同浓度的硫酸溶液20mL,充分反应后滤出硫,微热滤液使生成的SO2全部逸出。
测得有关实验数据如下(标准状况):
|
|
第一份 |
第二份 |
第三份 |
|
样品的质量/g |
12.60 |
18.90 |
28.00 |
|
二氧化硫的体积/L |
1.12 |
1.68 |
2.24 |
|
硫的质量/g |
1.28 |
1.92 |
2.56 |
 (摩尔质量:Na2S2O3·5H2O 248g/mol;Na2SO3 126g/mol;Na2SO4 142g/mol)
(摩尔质量:Na2S2O3·5H2O 248g/mol;Na2SO3 126g/mol;Na2SO4 142g/mol)
(1)计算所用硫酸溶液的物质的量浓度
(2)试确定该样品的成分并计算各成分的物质的量之比
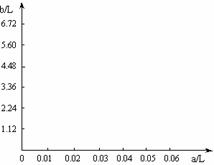
(3)若将63g该样品和一定量的上述硫酸溶液混合微热。试分析:当加入硫酸的体积(a L)在不同取值范围时,生成的SO2体积(b L)的值(请用含a的关系式表示),并在下图中画出b随a变化的曲线。
27].为了测定溶液中Ba2+的浓度,做了以下实验:①称取0.1323g K2Cr2O7溶于适量的稀硫酸中,再向其中加入过量的KI溶液与之反应,反应后的溶液加入27.00mL Na2S2O3溶液时恰好反应完全。②另取50.00mLBa2+溶液,控制适当的酸度,加入足量K2CrO4的溶液,得黄色沉淀,沉淀经过滤、洗涤后,用适量稀盐酸溶解,再加入过量KI与之反应,反应后再同上述Na2S2O3溶液反应,反应完全时,消耗Na2S2O3溶液24.00mL(I2+2Na2S2O3=Na2S4O6+2NaI)。
(1)配平离子方程式: Cr2O72-+ I-+ H+-- Cr3++ I2+ H2O
(2)黄色沉淀是 ,写出盐酸溶解该沉淀的离子反应方程式
(3)预测KMnO4和K2Cr2O7酸性条件下的氧化性强弱,并用本题有关的理由说明。
(4)上述两步可用 作指示剂,其现象 。
(5)试计算溶液中Ba2+的物质的量浓度
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com