
题目列表(包括答案和解析)
|
一 |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
二 |
11 |
12 |
13 |
14 |
15 |
16 |
17 |
18 |
19 |
20 |
|
|
|
|
|
|
|
|
|
|
|
|
19].某温度下,密闭容器中,发生如下可逆反应:2E(g) F(g)+xG(g);(正反应放热)。若起始时E浓度为a mol/L,F、G浓度均为0,达平衡时E浓度为0.5a mol/L;若E的起始浓度改为2a mol/L,F、G浓度仍为0,当达到新的平衡时,下列说法正确的是
F(g)+xG(g);(正反应放热)。若起始时E浓度为a mol/L,F、G浓度均为0,达平衡时E浓度为0.5a mol/L;若E的起始浓度改为2a mol/L,F、G浓度仍为0,当达到新的平衡时,下列说法正确的是
A 升高温度时,正反应速率加快、逆反应速率减慢
B 若x=1,容器体积保持不变,新平衡下E的体积分数为50%
C 若x=2,容器体积保持不变,新平衡下F的平衡浓度为0.5a mol·L-1
D 若x=2,容器压强保持不变,新平衡下E的物质的量为a mol
17].某研究性学习小组为了探索镁粉与溴水反应的机理,做了如下四组实验:
①将镁粉投入冷水中,未见任何现象;
②将镁粉放入溴水中,观察到只是开始时产生极少量的气泡,但溴水的颜色逐渐褪去;
③将镁粉放入液溴中,未观察到任何明显现象;
④向含足量镁粉的液溴中滴加几滴水,观察到溴的红棕色很快褪去。
则下列关于镁与溴水的反应机理的论述中正确的是
A 镁粉只直接与溴水中的溴反应 B 镁粉只与溴水中的酸反应
C 产生极少量的气泡是由于镁粉与水反应得到 D 镁粉在水的催化下与溴发生反应
 [18].右图是某空间站能量转化系统的局部示意
图,其中燃料电池采用KOH为电解液,下列有关
说法中不正确的是
[18].右图是某空间站能量转化系统的局部示意
图,其中燃料电池采用KOH为电解液,下列有关
说法中不正确的是
A 该能量转化系统中的水也是可以循环的
B 燃料电池系统产生的能量实际上来自于水
C 水电解系统中的阴极反应:O2+2H2O+4e-=4OH-
D 燃料电池放电时的负极反应:H2-2e-+2OH-=2H2O
高二化学竞赛联考题(一)
(时间:120分钟 满分:150分)
班级: 姓名:
|
H 1.008 |
相对原子质量 |
He 4.003 |
|||||||||||||||
|
Li 6.941 |
Be 9.012 |
|
B 10.81 |
C 12.01 |
N 14.01 |
O 16.00 |
F 19.00 |
Ne 20.18 |
|||||||||
|
Na 22.99 |
Mg 24.31 |
Al 26.98 |
Si 28.09 |
P 30.97 |
S 32.07 |
Cl 35.45 |
Ar 39.95 |
||||||||||
|
K 39.10 |
Ca 40.08 |
Sc 44.96 |
Ti 47.88 |
V 50.94 |
Cr 52.00 |
Mn 54.94 |
Fe 55.85 |
Co 58.93 |
Ni 58.69 |
Cu 63.55 |
Zn 65.39 |
Ga 69.72 |
Ge 72.61 |
As 74.92 |
Se 78.96 |
Br 79.90 |
Kr 83.80 |
|
Rb 85.47 |
Sr 87.62 |
Y 88.91 |
Zr 91.22 |
Nb 92.91 |
Mo 95.94 |
Tc [98] |
Ru 101.1 |
Rh 102.9 |
Pd 106.4 |
Ag 107.9 |
Cd 112.4 |
In 114.8 |
Sn 118.7 |
Sb 121.8 |
Te 127.6 |
I 126.9 |
Xe 131.3 |
|
Cs 132.9 |
Ba 137.3 |
La-Lu |
Hf 178.5 |
Ta 180.9 |
W 183.8 |
Re 186.2 |
Os 190.2 |
Ir 192.2 |
Pt 195.1 |
Au 197.0 |
Hg 200.6 |
Tl 204.4 |
Pb 207.2 |
Bi 209.0 |
Po [210] |
At [210] |
Rn [222] |
|
Fr [223] |
Ra [226] |
Ac-La |
Rf |
Db |
Sg |
Bh |
Hs |
Mt |
Ds |
|
16].进行化学实验,观测实验现象,通过分析推理得出正确的结论是化学学习的方法之一。对下列实验事实的解释正确的是
A 在KI淀粉溶液中通入氯气,溶液变蓝,说明氯气能与淀粉发生显色反应
B 浓硝酸在光照条件下变黄,说明浓硝酸不稳定,有有色产物生成能溶于浓硝酸
C 在某溶液中加入硝酸酸化的氯化钡溶液,有白色沉淀生成,说明含硫酸根离子
D 将铜片放入浓硫酸中,无明显实验现象,说明铜在冷的浓硫酸中发生钝化
15].下列反应的离子方程式书写正确的是
A NaHCO3的水解:HCO3-+H2O H3O++CO32-
H3O++CO32-
B 硫酸亚铁溶液中加入过氧化氢溶液:2Fe2++H2O2+2H+=2Fe3++2H2O
C 硫酸铜溶液中加入氢氧化钡溶液:Ba2++SO42-=BaSO4↓
D 除去KNO3溶液中的Fe3+:Fe3++3H2O Fe(OH)3↓+3H+
Fe(OH)3↓+3H+
14].用NA表示阿伏加德罗常数的值,下列说法中正确的是
A 100mL 1mol/L FeCl3溶液中含阳离子数为0.1NA
B 常温常压下1 mol NO2气体与水反应生成NA个NO3-离子
C 0.6 g CaCO3与Mg3N2的混合物中所含质子数为0.3NA
D 80mL 10mol/L浓盐酸与足量MnO2反应,转移电子数为0.4NA
13].甲酸和乙酸都是弱酸,当他们的浓度均为0.10mol·L-1时,甲酸中的c(H+)约为乙酸中c(H+)的3倍。现有甲酸溶液a和乙酸溶液b,经测定他们的pH:pHa=pHb。由此可知
A c(甲酸)=3c(乙酸) B c(甲酸)=1/3c(乙酸)
C 两溶液中水电离出的c(OH-)相同
D 等体积的a、b溶液用NaOH溶液中和时,消耗NaOH的物质的量a<b
12].A、B、C是短周期的三种元素,原子序数依次递增,A与C为同族元素,C与A相互间可形成原子个数比为1︰2或1︰3的化合物,B与A相互间只能形成一种常见化合物,则下列说法正确的是
A 原子半径:A>B>C B B与A形成的化合物熔点高
C B可能是金属,也可能是非金属 D B与A形成的化合物中可能有非极性共价键
11].近日来,沈城巨能钙事件沸沸扬扬,原因在于部分巨能钙被检出含有双氧水,而双氧水有致癌性,可加速人体衰老。因此卫生部已开始加紧调查巨能钙。下列有关说法错误的是
A H2O2、Na2O2都属于过氧化物,都存在非极性共价键
B 双氧水是绿色氧化剂,可作医疗消毒剂,说明H2O2对人体无害
C H2O2既有氧化性,又有还原性,与Cl2、KMnO4反应是表现H2O2的氧化性
D H2O2做漂白剂是利用其氧化性,漂白原理与HClO类似、SO2不同
10].表为元素周期表短周期的一部分,有关元素X、Y、Z、M的说法不正确的是
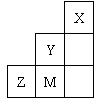 A X晶体的结构微粒是原子,故属于原子晶体
A X晶体的结构微粒是原子,故属于原子晶体
B Y、Z可形成ZY6分子
C 原子半径:Z>M>Y
D Z离子的结构示意图可表示为:
9].下列实验操作中错误的是
A 分液时,分液漏斗中下层液体从下口放出,上层液体从上口倒出
B 检查容量瓶是否漏水的方法是:往容量瓶中加水,塞好瓶塞,将容量瓶倒过来,若不漏水,将瓶塞旋转180°,再倒过来,看是否漏水
C 为加速固体物质的溶解常采取搅拌、加热等措施
D 使用pH试纸测量溶液的酸碱性时,先把pH试纸用蒸馏水湿润后,再测量
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com