
题目列表(包括答案和解析)
1.下列物质中,属于电解质的是
A.铁 B.H2SO4 C.蔗糖 D.酒精
27、(10分)将V mL NO和NO2的混合气体通过水吸收后得到a mL无色气体A,将此无色气体A与等体积氧气混合,再通过水充分吸收后,收集到20 mL无色气体B(气体的体积是在相同的条件下测定的)。
⑴A气体是 ,B气体是 。
⑵A气体的体积是 mL。
⑶V值的范围是 。
26.(6分)在一定温度下, 1molN2和3molH2发生下列反应:
N2(g)+ 3H2(g)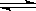 2NH3(g)
△H<0
2NH3(g)
△H<0
(1)若在起始体积都是1L的定压密闭容器中和定容密闭容器中建立反应,先达到平衡的
是 密闭容器, H2的转化率高的是 密闭容器(填定压或定容)
(2)若在上述定压容器中反应达到平衡时,平衡混和物中NH3的体积分数是a。仍维持原温度,用x、y、z分别表示开始时N2、H2、NH3的加入量(mol),使反应达到平衡后平衡混和物中NH3的体积分数同样是a。则x、y、z满足的条件是 。
25、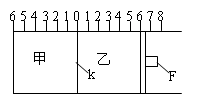 (6分)如图所示,甲、乙之间的隔板K和活塞F都可左右移动,活塞F右边与大气相通;甲中充入2molA和1molB,乙中充入2molC和1molHe,此时K停在0处。在一定条件下发生可逆反应:2A(g)+B(g)
(6分)如图所示,甲、乙之间的隔板K和活塞F都可左右移动,活塞F右边与大气相通;甲中充入2molA和1molB,乙中充入2molC和1molHe,此时K停在0处。在一定条件下发生可逆反应:2A(g)+B(g) 2C(g);经过一段时间反应达到平衡。回答下列问题:
2C(g);经过一段时间反应达到平衡。回答下列问题:
(1)可根据 的现象来判断甲、乙容器中的反应
已达到平衡。
(2)达到平衡时,隔板K最终停留在0刻度左侧a处,则a的取值范围是 。
(3)若达到平衡时,隔板K最终停留在左侧刻度1处,则甲中C的物质的量为 mol。
24.(8分)(1)简述PH试纸的使用方法
。
(2) 某温度时,水的离子积为KW=1×10-13,则该温度 (填<、>、=)25℃;将此温度下pH=12的苛性钠溶液aL与pH=1的稀硫酸bL混合,若混合溶液的 pH=2,则a:b= 。
23、(8分)现有A、B、C、D、E、F、G、H、I九种常见的物质,其中常温下A、B、F、H、I为气体,E、I为单质,G溶液呈蓝色,现代医学研究表明F分子在人体内有独特功能,它与血红蛋白结合的能力比CO更强。H分子中含有10个电子,A、B最简式相同,A的相对分子质量大于B的相对分子质量。A-I九种物质间的相互转化关系如下。(图中反应条件略去)
 试回答以下问题:
试回答以下问题:
(1)写出H分子的电子式 。
(2)写出反应①的化学方程式: 。
反应②的离子方程式: 。
(3)实验室若要测定B的相对分子质量,适宜的条件是 。
22、(4分)某无色混合气体可能由Cl2 、O2 、N2、NH3、NO、CO2、HCl中的一种或几种组成。室温下将该混合气体通过足量的浓硫酸,体积减少,剩余气体再通过足量碱石灰,体积又减少,余下的气体接触空气后立即变色。则原混合气体中一定含有的气体是 ;可能含有的气体是 。
21、 (8分)A是一种白色晶体,它与浓NaOH溶液共热放出无色气体B。用圆底烧瓶收集干燥的B。按右图装置仪器,挤压胶头滴管时,可以得到蓝色喷泉。A与浓H2SO4反应,放出无色气体C,用圆底烧瓶收集干燥的C,仍按右图装置仪器,挤压胶头滴管时可以得到红色喷泉,而B、C混合会产生白烟。
(8分)A是一种白色晶体,它与浓NaOH溶液共热放出无色气体B。用圆底烧瓶收集干燥的B。按右图装置仪器,挤压胶头滴管时,可以得到蓝色喷泉。A与浓H2SO4反应,放出无色气体C,用圆底烧瓶收集干燥的C,仍按右图装置仪器,挤压胶头滴管时可以得到红色喷泉,而B、C混合会产生白烟。
|
 (2)检验气体B的方法是
(2)检验气体B的方法是
。
(3)写出A与浓NaOH溶液加热时反应的离子方程式:
|
 。
。
(4)写出实验室以A为原料制取气体B的化学方程式:
。
20、为了更合理地表示溶液的酸碱性,科学家提出“酸度”(用AG表示)概念,
AG=lg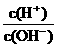 . 下列叙述正确的是
. 下列叙述正确的是
①任何温度下,水的AG等于0
②溶液的AG越小,酸性越强
③常温下,0.1mol/L盐酸的AG=12
④25℃时,某溶液的AG=-10,其pH=10
A、①② B、②④ C、①③ D、③④
选择题答题卡
第II卷 非选择题(共50分)
19、在室温下,下列等体积的酸和碱溶液混合后,pH一定小于7的是
A、pH=3的HNO3与pH=11的KOH溶液
B、pH=3的盐酸与pH=11的氨水
C、pH=3的硫酸与pH=11的NaOH溶液
D、pH=3的醋酸与pH=11的Ba(OH)2溶液
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com