
题目列表(包括答案和解析)
15.两学生用同一瓶标准盐酸滴定同一瓶氢氧化钠溶液,甲将锥形瓶用NaOH待测液润洗后,用经水洗涤后的碱式滴定管移取碱液于锥形瓶中。乙则接着以甲用过的碱式滴定管移取碱液于刚用水洗过的锥形瓶中(锥形瓶中留有较多的蒸馏水)其它操作的读数均正确。则
A.甲操作有错 B.乙操作有错
C.甲测定数值一定比乙小 D.乙实际测得的数据准确
14.25℃时,pH=3的盐酸中由水电离出的H+离子浓度是pH=5的盐酸中由水电离的H+
离子浓度的多少倍
A.10-2 B.102 C.2 D.12
13. 某温度下,反应H2(g)+I2(g) 2HI(g) △H< 0,在一带有活塞的密闭容器中达到平衡,下列说法不正确的是
某温度下,反应H2(g)+I2(g) 2HI(g) △H< 0,在一带有活塞的密闭容器中达到平衡,下列说法不正确的是
A.恒温压缩体积,平衡不移动,颜色加深 B.恒压迅速充入HI,开始时正反应速率减小
C.恒容,升温正反应速率减小 D.恒容,充入H2,I2的百分比含量降低
12. 化学反应
3A(g)+Q(g) 2R(g)+2S(g) 达平衡后,增大压强,下列叙述正确的是
化学反应
3A(g)+Q(g) 2R(g)+2S(g) 达平衡后,增大压强,下列叙述正确的是
A.正、逆反应速率都增大,平衡不发生移动
B.正、逆反应速率都增大,平衡向正反应方向移动
C.正反应速率减小,逆反应速率增大,平衡向逆反应方向移动
D.正反应速率增大,逆反应速率减小,平衡向正反应方向移动
11.下列反应的离子方程式正确的是
A.硫酸与氢氧化钡溶液反应: H++SO42-+Ba2++OH-=BaSO4↓+H2O
B.碳酸氢钠溶液与足量氢氧化钡溶液混合:HCO3-+Ba2++OH-=BaCO3↓+H2O
C.盐酸滴入氨水中:H++OH-=H2O
D.碳酸钙溶解于稀硝酸中:CO32-+2H+=CO2↑+H2O
10.人体血液的正常pH约为7.35-7.45,若在外界因素
作用下pH突然发生较大的改变就会引起“酸中毒”或“碱中毒”,甚至有生命危险。由于
人体体液的缓冲系统中存在如下平衡:

 H++HCO3- H2CO3 CO2+H2O
H++HCO3- H2CO3 CO2+H2O
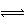
 H++PO43- HPO42- H++
HPO42- H2PO4-
H++PO43- HPO42- H++
HPO42- H2PO4-
故能维持血液pH的相对稳定,以保证正常生理活动。下列说法中不合理的是
A.当强酸性物质进入人体的体液后,上述缓冲系统的平衡向右移,从而维持pH稳定
B.当强碱性物质进入人体的体液后,上述缓冲系统的平衡向左移,从而维持pH稳定
C.某病人在静脉滴注大量生理盐水后,血液被稀释,会导致c(H+)显著减少,pH值显著增大,可能会引起碱中毒
D.在人体进行正常呼吸活动时,CO2进入血液,会使平衡向左移动,c(H+)略增大,pH值改变很小
8. 反应4A(s)+3B(g)===2C(g)+D(g),经2 min,B的浓度减少0.6 mol·L-1,对此反应速率的表示,正确的是
A.用A表示的反应速率是0.4 mol·L-1·min-1
B.分别用B、C、D表示反应的速率,其比值是3:2:1
C.在2 min末的反应速率,用B表示是0.3 mol·L-1·min-1
D.在这2 min内用B和C表示的反应速率的值都是逐渐减小的
|
 9.pH=1的两种酸溶液A、B各1 mL,分别加水稀释到1000mL,其pH值与溶液体积的关系如图,下列说法正确的是
9.pH=1的两种酸溶液A、B各1 mL,分别加水稀释到1000mL,其pH值与溶液体积的关系如图,下列说法正确的是
A.A、B两种酸溶液的物质的量浓度一定相等
B.稀释后,A酸溶液的酸性比B酸溶液强;
C.若a = 4,则A是强酸,B是弱酸;
D.若1< a < 4,则A、B都是弱酸。
7.下列关于盐酸与醋酸两种稀溶液的说法正确的是
A.相同浓度的两溶液中c(H+)相同
B.100mL 0.1mol/L的两溶液能中和等物质的量的氢氧化钠
C.pH=3的两溶液稀释100倍,pH都为5
D.相同浓度时导电能力醋酸强
6.已知在25℃、101k Pa下,1g C8H18(辛烷)燃烧生成二氧化碳和液态水时放出48.40 kJ的热量。表示上述反应的热化学方程式正确的是
A.C8H18(l)+ O2(g)===8CO2(g)+9H2O(g);△H= -48.40 kJ·mol-1
O2(g)===8CO2(g)+9H2O(g);△H= -48.40 kJ·mol-1
B.C8H18(l)+ O2(g)===8CO2(g)+9H2O(l);△H= -5518 kJ·mol-1
O2(g)===8CO2(g)+9H2O(l);△H= -5518 kJ·mol-1
C.C8H18(l)+ O2(g)===8CO2(g)+9H2O(l);△H= +5518 kJ·mol-1
O2(g)===8CO2(g)+9H2O(l);△H= +5518 kJ·mol-1
D.C8H18(l)+ O2(g)===8CO2(g)+9H2O(l);△H= -48.40
kJ·mol-1
O2(g)===8CO2(g)+9H2O(l);△H= -48.40
kJ·mol-1
5.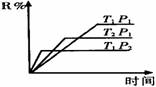
 在密闭容器中进行下列反应:M(气)+N(气) R(气)+2L此反应符合下面图象,下列叙述正确的是
在密闭容器中进行下列反应:M(气)+N(气) R(气)+2L此反应符合下面图象,下列叙述正确的是
A.正反应吸热,L是气体
B.正反应吸热,L是固体或液体
C.正反应放热,L是气体
D.正反应放热,L是固体或液体
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com