
题目列表(包括答案和解析)
3.下列各组物质中,互为同系物的是( )
(A)金刚石和石墨 (B)顶烷和丁烯 (C)35Cl和37Cl (D)甲烷和丙烷
2.既能与盐酸反应,又能与氢氧化钠溶液反应生成盐和水的物质是( )
(A)铝 (B)硅 (C)碳酸钠 (D)氧化铝
1.为了减少大气污染,许多城市推广使用汽车清洁燃料。目前使用的清洁燃料主要有两类,一类是压缩天然气(CNG),另一类是液化石油气(LPG)。这两类燃料的主要成分都是( )
(A)碳水化合物 (B)碳氢化合物 (C)氢气 (D)醇类
22.(9分)室温下,有pH=2的硫酸溶液100ml,欲使其pH变为3,可向其中加入水、碱溶液或更稀的酸。请计算(混合后溶液体积的变化忽略不计):
⑴加入水的体积。
⑵加入0.1mol/L的NaOH溶液的体积。
21.(7分))在一定条件下,CH4 和CO的燃烧的热化学方程式分别为:
CH4 ( g ) + 2O2 ( g ) = 2H2O ( l ) + CO2 ( g ) △H = -890 kJ/mol
2CO ( g ) + O2 ( g ) = 2CO2 ( g ) △H = -566 kJ/mol
一定量的CH4和CO的混合气体完全燃烧时,放出的热量为262.9 kJ,生成的CO2用过量的饱和石灰水完全吸收,可得到50 g白色沉淀。求混合气体中CH4 和CO的体积比。
20.(11分)一定条件下,将SO2和O2充入一密闭容器中,发生如下反应:
 2SO2(g)+O2(g) 2SO3(g)(正反应放热)反应过程中SO2、O2、SO3物质的量变化如图所示:回答下列问题:
2SO2(g)+O2(g) 2SO3(g)(正反应放热)反应过程中SO2、O2、SO3物质的量变化如图所示:回答下列问题:
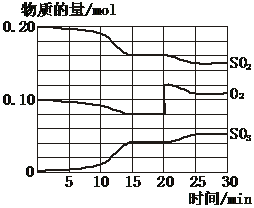
(1)写出该反应的化学平衡常数表达式:K= ;
降低温度, K值 ;SO2的转化率_____ __,化学反应速度____ ___。
(填“增大”“减小”或“不变”)
(2)反应处于平衡状态的时间段是____ ___。
(3)反应进行至20 min时,曲线发生变化的原因是________ ______________(用文字表达)。10 min到15 min的曲线变化的原因可能是_________(填写编号)。
a. 加了催化剂 b. 缩小容器体积
c. 降低温度 d. 增加SO3的物质的量
19.( 10分)有pH=1的盐酸、硫酸、醋酸三瓶溶液:(用>、<、= 表示,下同)
(1)设三种溶液的物质的量浓度依次为C1、C2、C3,则其关系是 。
(2)取相同体积的三种酸分别加入蒸馏水稀释到pH=3,需水的体积依次为V1、V2、V3,则其关系是 。
(3)完全中和体积和物质的量浓度均相同的Ba(OH)2溶液时,需三种酸的物质的量依次为n1、n2、n3,则其关系是 。
(4)取同体积的酸的溶液分别加入足量的锌粉,反应开始放出H2的速率依次为υ1、υ2、υ3,则其关系是 ;反应过程中放出H2的速率依次为υ/1、υ/2、υ/3,则其关系是 。
18.( 11分)某同学用中和滴定法测定某烧碱的纯度,实验过程如下:
(1)配制待测液:称取4.1g固体烧碱样品(杂质不与酸反应)配制成250ml溶液,需要的主要仪器有 。
(2)滴定
① 用 量取10.00ml待测液。
② 用0.2010mol·L-1标准盐酸滴定待测烧碱溶液,加入几滴酚酞,边滴边摇动锥形瓶,眼睛注视 ,直到 时停止滴定
(3)数据处理
|
实验次数编号 |
盐酸溶液体积 V(ml) |
氢氧化钠溶液体积 V(ml) |
|
1 |
19.90 |
10.00 |
|
2 |
20.10 |
10.00 |
|
3 |
22.00 |
10.00 |
|
4 |
20.00 |
10.00 |
根据上述各数据,选取合适的三组,计算待测烧碱溶液的浓度为 ,烧碱的纯度为 。
(4下列操作,会导致实验结果偏低是 (填序号)。
①碱式滴定管用蒸馏水洗净后没有用待测液润洗
②终点读数时俯视(滴定前读数准确)
③锥形瓶用蒸馏水洗净后没有用待测液润洗
④酸式滴定管尖端气泡没有排除,滴定后消失
⑤酸式滴定管用蒸馏水洗净后没有用标准液润洗
⑥振荡时锥形瓶中液滴飞溅出来
17.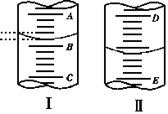 ( 4分)(1)图1表示10mL量筒中液面的位置,A与B, B与C刻度间相差1mL, 如果刻度A为4,量筒中
( 4分)(1)图1表示10mL量筒中液面的位置,A与B, B与C刻度间相差1mL, 如果刻度A为4,量筒中
液体的体积是________mL。
(2)图II表示50mL滴定管中液面的位置,如果液面处的读数是a,则滴定管中液体的体积(填代号) _。
A.是a ml B.是(50-a)ml C.一定大于a ml D.一定大于(50-a)ml
16.下列说法不正确的是
A.体系有序性越高,熵值就越低
B.知道了某过程有自发性之后可预测过程完成的快慢
C.吸热反应不可以自发进行
D.同种物质气态时熵值最大
Ⅱ卷 (非选择题56分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com