
题目列表(包括答案和解析)
3..用NA代表阿伏加德罗常数,下列说法正确的是
A 0.5mol Al与足量盐酸反应转移电子数为1NA
B 标准状况下,11.2L SO3所含的分子数为0.5NA
C 0.1mol CH4所含的电子数为1NA
D 46g NO2和N2O4的混合物含有的分子数为1N
2.天然纤维的吸湿性优于于合成纤维,下列合成纤维中吸湿性最好的是
A、聚乙烯醇纤维(维纶) B、聚酯纤维(涤纶)
C、聚酰胺纤维(锦纶) D、聚丙烯纤维(丙纶)
1.下列化学名词正确的是( )
A、三溴笨酚 B、坩锅 C、溶量瓶 D、烧碱
31.(6分)在由铜锌组成的原电池(电解质是稀硫酸)中,有位同学在铜电极收集到了12g的气体,
(1) 铜锌原电池的总反应的离子方程式为:___________________________________________________________________
(2) 铜电极产生12g气体的过程中有 克的锌溶解。
(3) 铜电极产生12g气体的过程中有 摩尔的电子发生了转移。
30. (14分)两只密闭容器A和B,A能保持恒压,B能保持恒容。起始时向容积相等的A、B中分别通入体积比为2∶1的等量的SO2和O2,使之发生反应:2SO2+O2 2SO3,并达到平衡。则(填>、=、<;正、逆;增大、减小、不变)。
2SO3,并达到平衡。则(填>、=、<;正、逆;增大、减小、不变)。
⑴ 达到平衡所需要的时间:t(A) t(B),SO2的转化率:a(A) a (B)
⑵反应过程中的反应速率:v(A) v(B)。
⑶ 达到平衡时,在两容器中分别通入等量的Ar气。A中的化学平衡向 反应方向移动,B中的化学反应速率 。
⑷ 达到平衡后,向两容器中分别通入等量的原反应气体,再次达到平衡时,A容器中SO2的百分含量 ,B容器中SO2的百分含量
29.(16分)已知X、Y、Z、W是元素周期表中短周期中的四种非金属元素,它们的原子序数依次增大,X元素的原子形成的阳离子就是一个质子,Z、W在元素周期表中处于相邻的位置,它们的单质在常温下均为无色气体,Y原子的最外层电子数是内层电子数的2倍。试回答:
(1)写出下列元素的元素符号和该原子的外围电子排布式:
X Y
Z W
(2)X单质和Z单质在一定条件下反应生成化合物E,该反应的化学方程式为 。E在催化剂存在的条件下可用于还原汽车尾气中的 ,以减少对大气的污染。
(3)仅由X、Z、W三种元素组成的某种盐是一种速效肥料,但长期施用会使土壤酸化,有关的离子反应方程式为
 (4)这四种元素可组成原子个数比为5∶1∶1∶3的化合物(按X、Y、Z、W的顺序),该化合物的水溶液与足量NaOH溶液反应的化学方程式为
(4)这四种元素可组成原子个数比为5∶1∶1∶3的化合物(按X、Y、Z、W的顺序),该化合物的水溶液与足量NaOH溶液反应的化学方程式为
28.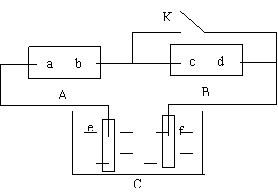 (12分)右图A为直流电源,B为渗透饱和氯化钠溶液和酚酞试液的滤纸,C为电镀槽,接通电路后,发现B 上的 C 点显红色,请填空:
(12分)右图A为直流电源,B为渗透饱和氯化钠溶液和酚酞试液的滤纸,C为电镀槽,接通电路后,发现B 上的 C 点显红色,请填空:
(1)电源A的a为 极。
(2)滤纸B上发生的总反应方程式为:
。
(3)欲在电镀槽中实现铁上镀锌,接通K点,使c、d两点短路,则
电极e上发生的反应为: ,
电极f上发生的反应为: ,
槽中盛放的镀液可以是 或 (只要求填两种电解质溶液)。
27.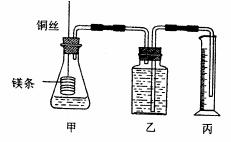 (14分)某研究性学习小组为证明在同温同压下,相同浓度相同体积的酸性强弱不同的一元酸与足量镁带反应时,生成氢气的体积相同而反应速率不同。设计的简易实验装置如下图。该实验的主要操作步骤如下:
(14分)某研究性学习小组为证明在同温同压下,相同浓度相同体积的酸性强弱不同的一元酸与足量镁带反应时,生成氢气的体积相同而反应速率不同。设计的简易实验装置如下图。该实验的主要操作步骤如下:
① 配制浓度均为 1 mol/L 盐酸和醋酸溶液;
② 用 量取 10.00mL 1 mol/L 盐酸和醋酸溶液分别加入两个锥形瓶中;
③ 分别称取除去表面氧化膜的镁带 a g ,并系于铜丝末端,a 的数值理论上最少应为 g;
④ 在广口瓶中装足量的水,按图连接好装置;检查装置的气密性;
⑤ 将铜丝向下移动,使足量镁带浸入酸中(铜丝不与酸接触),至反应完全,记录 ;
⑥ 反应结束后待温度恢复到室温,若丙中液面高于乙中液面,读取量筒中水的体积前,应该进行的操作是:
,然后读出量筒中水的体积为 VmL。
请将上述步骤补充完整并回答下列问题:
(1)本实验中应选用 (填序号)的量筒。
A.50 mL B.200 mL C.100 mL
(2)简述速率不等的原因 。
铜丝不与酸接触的原因是 。
26. (4分)化学中有一些貌似很难的问题,其实这是对化学原理理解的偏差所造成的,认真思考下面问题,看一看你是否具有“火眼金睛”。
问题一:已知NaAc溶液中存在着如下水解平衡:Ac一+H2O HAc+OH一,当加入少量氢氧化钠固体后(不考虑体积的变化),溶液中c(Ac一)如何变化?
HAc+OH一,当加入少量氢氧化钠固体后(不考虑体积的变化),溶液中c(Ac一)如何变化?
甲同学认为:加入的氢氧化钠和生成的HAc反应,使平衡向右移动,所以c(Ac一)减小。
乙同学认为:加入氢氧化钠后溶液中的c(OH一)增大,使平衡向左移动,所以c(Ac一)增大。你认为 正确。
问题二:已知某容器中A(g)+2B(g)  2C(g)反应达到平衡,当增大容器体积,达到新平衡时,B的浓度如何变化?
2C(g)反应达到平衡,当增大容器体积,达到新平衡时,B的浓度如何变化?
甲同学认为:体积增大,平衡左移,B的物质的量增大,所以B的浓度应是增大的。
乙同学认为:虽然平衡左移,但由于体积也增大了,所以B的浓度应是减小的。你认为 正确。
25. (4分)有pH=1的盐酸、硫酸和醋酸溶液:(用>、<、=表示a, b, c的关系)
(1) 设三种溶液的物质的量浓度分别为a, b, c, 则它们的关系是 。
(2)取同体积的酸溶液加入适量的NaOH恰好完全中和时,所得溶液的pH分别为a, b, c, 则它们的关系是 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com