
题目列表(包括答案和解析)
17.(4分)下列有关实验操作或结果的说法中正确的是
A.将pH试纸用蒸馏水湿润后,测量某溶液的pH
B.把铜片和铁片紧靠在一起浸入稀硫酸中,铜片表面出现气泡
C.滴定管洗净后经蒸馏水润洗后,即可注入标准液进行中和滴定实验
D.电解盐酸溶液后(盐酸过量),再通入一定量HCl气体时,电解质溶液可恢复到和原来一样
E.用广泛pH试纸测量Na2S溶液的pH时,得pH=10.5
F.实验室在配制FeCl3溶液时,先将FeCl3溶于一定量的浓盐酸中,再加蒸馏水稀释至所需浓度
16.下列实验方案中不能实现:Fe+H2SO4=FeSO4+H2↑反应的是
A.用导线将铁片和锌棒连接后,放入一盛有稀 H2SO4溶液的烧杯中
B.将铁片直接放入一盛有稀 H2SO4溶液的烧杯中
C.Cu片作阴极,铁片作阳极,电解一定量的H2SO4溶液
D.Cu片作阳极,铁片作阴极,电解一定量的H2SO4溶液
(请将选择题答案填入下表中)
第Ⅱ卷(非选择题 共64分)
15.某化学兴趣小组同学探索某些溶液的酸碱性。25℃时他们分别测得CH3COOH和(NH4)2SO4两种溶液的pH都为4,并对结果作了以下四种分析。则其中正确的是
A.(NH4)2SO4溶液呈酸性是因为NH4+电离出H+
B.因为醋酸是弱酸,所以醋酸溶液中水的电离平衡被促进了
C.CH3COOH和(NH4)2SO4溶液中水的电离出来的H+的物质的量浓度相同
D.CH3COOH和(NH4)2SO4两水溶液呈酸性的原因不同
14.可逆反应H2(g)+I2(g)  2HI(g)
2HI(g)  H<0 达到平衡后,当改变外界条件如物质浓度、体系压强、温度等而发生下列项目的变化时,能作为平衡一定发生了移动的标志的是
H<0 达到平衡后,当改变外界条件如物质浓度、体系压强、温度等而发生下列项目的变化时,能作为平衡一定发生了移动的标志的是
A.气体的密度变小了 B.反应物和生成物浓度均变为原来的2倍
C.气体的颜色变深了 D.体系的温度发生了变化
13.在给定的四种溶液中,加入以下各种离子,各离子可能在原溶液中大量共存的是 A.滴加石蕊试液显红色的溶液 Fe3+、NH4+、Cl-、S2- B.pH=1的溶液 Cu2+、Na+、Mg2+、NO3- C.水电离出来的c(H+)=10-13mol/L的溶液 K+、HCO3-、Br-、Ba2+ D.Na2SO4溶液 K+、Ba2+、NO3-、Cl-
12.某同学在做中和滴定实验时,用1.0 mol/L NaOH溶液滴定未知浓度的H2SO4溶液,滴定过程中溶液的pH和所用NaOH溶液的体积关系如下图所示,则原H2SO4的物质的量浓度和完全反应后溶液的大致体积是
 A.1.0mol/L、60mL
B.1.0mol/L、40mL
A.1.0mol/L、60mL
B.1.0mol/L、40mL
C.0.5mol/L、80mL D.0.5mol/L、40mL
11.一定温度下,某密闭容器中发生如下反应:A(g)+B(g)  C(g) +D(g)
C(g) +D(g)
 H<0。当反应达到平衡时测得容器中各种物质均为amol。欲使C的平衡浓度增大一倍,在其他条件不变时,下列措施可采用的是
H<0。当反应达到平衡时测得容器中各种物质均为amol。欲使C的平衡浓度增大一倍,在其他条件不变时,下列措施可采用的是
A.降低温度 B.恒容时,再通入2amolC和2amolD
C.使容器的体积缩小一半 D.恒容时,再通入amolA和amolB
10. 在一定的条件下,将 2mol SO2和1mol O2充入一定容密闭容器中,发生下列反应:2SO2(g) + O2(g) 2SO3(g)
在一定的条件下,将 2mol SO2和1mol O2充入一定容密闭容器中,发生下列反应:2SO2(g) + O2(g) 2SO3(g)  H=-197 kJ/mol, 当达到平衡状态时,下列说法中正确的是
H=-197 kJ/mol, 当达到平衡状态时,下列说法中正确的是
A.生成 2 mol SO3 B.放出热量197 kJ
C.SO2 和 SO3 共有 2 mol D.含有氧原子共有3mol
9.已知在1×105Pa、298K条件下,2mol氢气燃烧生成水蒸气放出484kJ热量,下列热化学方程式正确的是
A.H2O(g)=H2(g)+ O2(g)
O2(g)  H= +242kJ/mol
H= +242kJ/mol
B.2H2(g)+O2(g)=2H2O(l)  H= -484kJ/mol
H= -484kJ/mol
C.H2+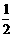 O2=H2O
O2=H2O
 H= -242kJ/mol
H= -242kJ/mol
D.H2(g)+ 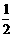 O2(g)=H2O(g)
O2(g)=H2O(g)
 H= -242kJ/mol
H= -242kJ/mol
8.据环保部门测定,我国一些大城市的酸雨pH=3.5。则在下雨(酸雨)时,该地区铁制品腐蚀的正极反应主要是
A.Fe -2e-=Fe2+ B.2H2O+O2+4e-=4OH-
C.2H++2e-=H2↑ D.4OH-- 4e-=2H2O+O2↑
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com