
题目列表(包括答案和解析)
13. 反应C(s)+H2O(g) CO(g)+ H2(g)在一可变容积的密闭容器中进行,在其它条件不变的情况下,下列条件的改变对其反应速率几乎无影响的是
反应C(s)+H2O(g) CO(g)+ H2(g)在一可变容积的密闭容器中进行,在其它条件不变的情况下,下列条件的改变对其反应速率几乎无影响的是
A.增加CO的物质的量
B.将容器的体积缩小一半
C.保持体积不变,充入N2使体系压强增大
D.保持压强不变,充入N2使容器体积变大
12.强酸和强碱稀溶液的中和热可以表示为:
H+(aq)+OH-(aq)=H2O(l);△H=-57.3kJ·mol-1
已知:①.HCl(aq)+NH3·H2O(aq)=NH4Cl(aq)+H2O(l);△H=a kJ·mol-1
②.HNO3(aq)+KOH(aq)=NaNO3(aq)+H2O(l);△H=c kJ·mol-1
③.HCl(aq)+NaOH(s)=NaCl(aq)+H2O(l);△H=b kJ·mol-1
则a、b、c三者的大小关系为
A.a>b>c B.c>b>a C.a=b=c D.a >c> b
11.下列热化学方程式中的反应热下划线处表示燃烧热的是
A.C6H12O6(s)+6O2(g) 6CO2(g)+6H2O(l);ΔH=-akJ·mol-1
6CO2(g)+6H2O(l);ΔH=-akJ·mol-1
B.CH3CH2OH(l)+ O2(g)
O2(g) CH3CHO(l)+H2O(l);ΔH=-bkJ·mol-1
CH3CHO(l)+H2O(l);ΔH=-bkJ·mol-1
C.CO(g)+  O2(g)
O2(g)
 CO2(g);ΔH=-c kJ·mol-1
CO2(g);ΔH=-c kJ·mol-1
D.NH3(g)+ O2(g)
O2(g) NO(g)+
NO(g)+ H2O(g);ΔH=-d
kJ·mol-1
H2O(g);ΔH=-d
kJ·mol-1
10.下列关于反应能量的说法正确的是
A.Zn(s)+CuSO4(aq)=ZnSO4(aq)+Cu(s);△H =-216kJ/mol,E反应物>E生成物
B.CaCO3(s)=CaO(s)+CO2(g); △H =+178.5kJ/mol,E反应物>E生成物
 C.HI(g) 1/2H2(g)+ 1/2I2(s);△H = -26.5kJ/mol,由此可知1mol
HI在密闭容器中分解后可以放出26.5kJ的能量
C.HI(g) 1/2H2(g)+ 1/2I2(s);△H = -26.5kJ/mol,由此可知1mol
HI在密闭容器中分解后可以放出26.5kJ的能量
D.H+(aq)+OH-(aq)=H2O(l);△H = -57.3kJ/mol,含1molNaOH水溶液与含0.5mol H2SO4的浓硫酸混合后放热57.3 kJ
9.
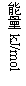
 参照反应Br + H2 HBr +H的能量对反应历程的示意图,下列叙述中正确的
参照反应Br + H2 HBr +H的能量对反应历程的示意图,下列叙述中正确的
A. 正反应为放热反应
B. 加入催化剂,该化学反应的反应热不改变
C. 正反应为吸热反应
D. 加入催化剂可增大正反应速率,降低逆反应速率
8.已知热化学反应方程式:
Zn(s)+ O2(g)
O2(g) ZnO(s);ΔH=-351.5 kJ·mol-1
ZnO(s);ΔH=-351.5 kJ·mol-1
Hg(l)+ O2(g)
O2(g)  HgO(s);ΔH=-90.84 kJ·mol-1
HgO(s);ΔH=-90.84 kJ·mol-1
则锌汞电池中热化学反应方程式:Zn(s)+HgO(s)
 ZnO(s)+Hg(l)的ΔH为
ZnO(s)+Hg(l)的ΔH为
A. ΔH=+260.7 kJ·mol-1 B. ΔH=-260.7 kJ·mol-1
C. ΔH=-444.2 kJ·mol-1 D. ΔH=+444.2 kJ·mol-1
7.同温同压下,下列各组热化学方程式中,△H1<△H2是
A.C(s)+ O2(g)=CO(g);△H1
C(s)+O2(g)=CO2(g);△H2
O2(g)=CO(g);△H1
C(s)+O2(g)=CO2(g);△H2
B. H2(g)+
H2(g)+ Cl2(g)=HCl(g);△H1 H2(g)+Cl2(g)=2HCl(g);△H2
Cl2(g)=HCl(g);△H1 H2(g)+Cl2(g)=2HCl(g);△H2
C.2H2(g)+O2(g)=2H2O(g);△H1 2H2(g)+O2(g)=2H2O(l);△H2
D.S(g)+O2(g)=SO2(g);△H1 S(s)+O2(g)=SO2(g); △H2
6.已知热化学方程:
2KNO3(s) = 2KNO2(s) +O2(g);△H = +58kJ/mol
C(s) +O2(g) = CO2(g);△H =-94kJ/mol
为提供分解1molKNO3所需的能量,理论上需完全燃烧碳
A.58/94mol B.58/(94×2) mol C.(58×2)/94mol D.(94×2)/58mol
5.在一个绝热的体积一定的密闭容器中发生可逆反应:
N2(g) + 3H2(g)  2NH3(g)
; △H<0
2NH3(g)
; △H<0
下列各项中不能说明该反应已经达到平衡状态的是 A.体系的压强不再改变 B.体系的温度不再改变 C.断裂1mol N≡N键的同时,也断裂6molN-H键 D.反应消耗的 、与产生的的速率υ() : υ() : υ() == 1∶3 ∶2
4. 在密闭容器中,一定条件下进行如下反应:
NO(g)+CO(g) 
 N2(g)+CO2(g);△H=-373.2kJ·mol-1 ,达到平衡后,为提高该反应的速率和NO的转化率,采取的正确措施是
N2(g)+CO2(g);△H=-373.2kJ·mol-1 ,达到平衡后,为提高该反应的速率和NO的转化率,采取的正确措施是
A. 加催化剂同时升高温度 B. 加催化剂同时增大压强
C. 升高温度同时充入N2 D. 降低温度同时增大压强
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com