
题目列表(包括答案和解析)
3.现有盐酸、熟石灰、烧碱、食盐四种物质,其中能用于金属除锈的是__________________,能用于改良酸性土壤的是__________________.
答案:盐酸 熟石灰
2.在实验室遇到下列情况,采用的方法正确的是 ( )
A.浓硫酸沾到手上,立即用大量水冲洗
B.没有说明NaOH溶液的用量,则取用1-2mL
C.少量盐酸滴在实验台上,立即用湿抹布擦净
D.酒精在实验台上燃烧起来,立即用水浇灭
答案:B
基础巩固
1.下列物质露置在空气中一段时间后,质量会减轻的是 ( )
A.生石灰 B.浓盐酸 C.浓硫酸 D.大理石
答案:B
20.硫酸厂排放的污水中通常含有硫酸杂质.为测定污水中硫酸的溶质质量分数做如下实验:取10g该污水,向污水中逐滴加入溶质质量分数为4%的氢氧化钠溶液,所滴加氢氧化钠溶液的质量与溶液pH变化关系如图所示.请根据实验计算,该污水中硫酸的溶质质量分数是多少?
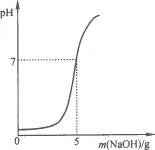
图10-8
答案:2.45%.
19.某兴趣小组用图10-7所示装置做酸碱中和反应实验,试回答:
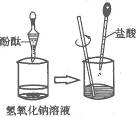
图10-7
(1)用胶头滴管吸取盐酸逐滴加入烧杯中,当溶液刚好由_______________色变成_______________色时,停止加入盐酸,该反应的化学方程式为________________________________________________.
(2)实验(1)中,某同学不小心又多加了几滴盐酸,这时溶液的pH_______________7(填“>”、“<”或“=”).
(3)若要除去实验(2)中过量的盐酸可选用的试剂是_______________(填化学式).
(4)中和反应在实际中具有广泛的应用,请举出一个实例:______________________________.
答案:(1)红色 五色 NaOH+HCl====NaCl+ H2O
(2)< (3)NaOH(或Na2CO3、NaHCO3、Na2O)
(4)(用熟石灰)改良酸性土壤、(用氢氧化铝)治疗胃酸过多、或用肥皂水(稀氨水)治疗蚊叮虫咬.
18.(2010,南昌)如图10-6所示,小田同学在进行酸碱中和反应的实验时,向烧杯中的氢氧化钠溶液滴加稀盐酸一会儿后,发现忘记了滴加指示剂.为了确定盐酸与氢氧化钠是否恰好完全反应,小田从烧杯中取了少量反应后的溶液于一支试管中,并向试管中滴加几滴无色酚酞试液,振荡,观察到酚酞试液不变色.于是她得出“两种物质已恰好完全中和”的结论.
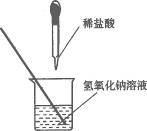
图10-6
(1)你认为她得出的结论是否正确?_______________,理由是___________________________.
(2)请你设计一个实验,探究上述烧杯中的溶液是否恰好完全中和.填写表10-6:
表10-6
|
实验方法 |
可能观察到的现象 |
结论 |
|
|
|
|
答案:(1)不正确 如果盐酸滴加过量,滴入酚酞试液也不变色
(2)(以下方法任写一种均可得分)如表D10-4.
表D10-4
|
①取样,滴加紫色石蕊试液 |
试液变红 |
盐酸过量 |
|
②取样,滴加紫色石蕊试液 |
试液不变红 |
恰好中和 |
|
③取样,滴加碳酸钠溶液 |
有气泡产生 |
盐酸过量 |
|
④取样,滴加碳酸钠溶液 |
无气泡产生 |
恰好中和 |
|
⑤取样,加入锌粒等活泼金属 |
有气泡产生 |
盐酸过量 |
|
⑥取样,加入锌粒等活泼金属 |
无气泡产生 |
恰好中和 |
知识积累
17.实验室有一瓶存放时间较长的氢氧化钠,其中的一部分已转化成了碳酸钠.现要用该药品配制10%的氢氧化钠溶液.取50.6g该药品,溶于200mL水中,然后慢慢地滴入17.1%的氢氧化钡溶液,当用去100 g氢氧化钡溶液时,碳酸钠恰好反应完全[Na2CO3+Ba(OH)2====BaCO3↓+2NaOH).求:
(1)50.6g该药品中碳酸钠的质量.
(2)滤出沉淀后所得溶液中溶质的质量和溶液的质量.
(3)向所得溶液中再加入多少毫升水才能配制成10%的氢氧化钠溶液?
解:设50.6g该药品中碳酸钠的质量为x,生成碳酸钡和氢氧化钠的质量分别为y和z,则:
(1)Ba(OH)2的质量:100g×17.1%=17.1 g
Na2CO3+Ba(OH)2====BaCO3++2NaOH
106 171 197 80
x 17.1 g y z
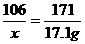 x=10.6g
x=10.6g
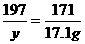 y=19.7g
y=19.7g
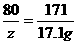 z=8g
z=8g
(2)NaOH溶液中溶质的质量=50.6 g-10.6g+8 g=48 g
NaOH溶液的质量:50.6 g+200 mL×1 g/mL+100 g-19.7g=330.9 g
(3)需加入水的体积:(48 g÷10%-330.9 g)÷1 g/mL=149.1 mL
答:(1)50.6 g该药品中碳酸钠的质量为50.6 g.
(2)滤出沉淀后所得溶液中溶质的质量为48g,溶液的质量为330.9 g.(3)向所得溶液中再加入149.1 mL水才能配制成10%的氢氧化钠溶液.
中考链接
16.实验探究:氢氧化钠溶液中哪一种粒子(H2O,Na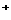 ,OH
,OH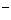 )能使指示剂变色.
)能使指示剂变色.
实验步骤:(1)在第一支试管中加入约2mL蒸馏水,滴入几滴无色酚酞试液,观察现象.
(2)在第二支试管中加入约2mLNaCl(pH=7)溶液,滴入几滴无色酚酞试液,观察现象.
(3)在第三支试管中加入约2mLNaOH溶液,滴入几滴无色酚酞试液,观察现象.通过上述实验的探究,回答下列问题(下述“现象”是指:无色酚酞试液是否变红)
实验(1)看到的现象是___________________,你得出的结论是___________________;实验(2)看到的现象是___________________,说明Na+离子___________________;实验(3)看到的现象是___________________,你得出的结论是____________________________.
答案:无明显变化 蒸馏水不能使酚酞变红 无明显变化 不能使酚酞变红 酚酞试液变红 OH 能使酚酞变红.
能使酚酞变红.
15.只用酚酞试液,鉴别稀HCl、NaOH溶液和NaCl溶液三瓶无色溶液.
答案:如表D10-3所示.
表D10-3
|
实验步骤 |
实验现象 |
实验结论 |
|
取三支洁净的试管,分别注入三种溶液少许,再分别滴加酚酞试液 |
有一支试管内溶液变红,另两支试管内溶液不变色 |
溶液变红的试管所装的原溶液为氢氧化钠溶液 |
|
用胶头滴管取另两种溶液中的任意一种,逐滴滴加到使酚酞试剂变红的溶液中 |
若红色逐渐褪去 |
所取溶液为稀盐酸,另一种溶液为氯化钠溶液, |
|
若红色不褪去 |
则所取溶液为氯化钠溶液,另一种溶液为稀盐酸 |
|
解析:稀HCl、NaOH溶液和NaCI溶液分别呈酸性、碱性、中性,用酚酞试剂只能鉴别也NaOH溶液(使酚酞试液变红).但是,稀HCl可以和NaOH溶液发生中和反应使红色褪去,而NaCl溶液不能.本题属于“实验鉴别题”中的一种,其特点是:限制试剂.解答这类题,首先是利用题目所给的试剂,鉴别出一种物质,再将这种物质作为试剂鉴别出其他的一种或几种物质.注意:酸溶液、碱溶液之间的中和反应没有明显的现象,通常借助酚酞试剂来显示是否反应以及判断何时恰好反应.
14.18世纪70年代,瑞典化学家舍勒首先发现了氯气(C12).氯气溶于水可生成盐酸和次氯酸(HClO).次氯酸具有漂白性,可将有色物质氧化成无色物质,某同学用滴管将饱和氯水(氯气的水溶液)逐滴滴入含有酚酞试液的NaOH溶液中,当滴到最后一滴时,红色突然褪去.
(1)写出氯气与水反应的化学方程式:________________________.
(2)红色褪去的原因可能有两种(用简要的文字说明):
①_____________________________________;②_____________________________________.
答案:(1)Cl+ H2O====HCl+HClO (2)①氯水中的酸与NaOH发生中和反应使溶液变为中性 ②次氯酸的漂白性使酚酞氧化成无色物质
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com