
题目列表(包括答案和解析)
20.下列无色澄清的溶液中,可能大量共存的离子组是
A.[Ag(NH3)2]+、K+、OH-、NO3- B.Fe3+、NH4+、Cl-、I-
|
19.原电池的电极名称不仅与电极材料的性质有关,也与电解质溶液有关。下列说法中不正
确的是
A.由Al、Cu、稀H2SO4组成原电池,其负极反应式为:Al-3e-=Al3+
B.由Mg、Al、NaOH溶液组成原电池,其负极反应式为:Al-3e-+4OH-=AlO2-+2H2O
C.由Fe、Cu、FeCl3溶液组成原电池,其负极反应式为:Cu-2e-=Cu2+
D.由Al、Cu、浓硝酸组成原电池,其负极反应式为:Cu-2e-=Cu2+
18.某一元弱酸HA的相对分子质量为M。在t℃时,将ag HA完全溶解于水,得v mL饱和溶液,测得该溶液的密度为ρg/cm3,其中n(A-)为b mol。下列叙述中,错误的是
A.溶液中c(H+)=[1000b+c(OH-)V]/V mol/L
B.物质的量浓度c(HA)=1000a/MV mol/L
C.t℃时,HA的溶解度S=100a/ρV g
D.HA的质量分数ω(HA)=(a/ρV)×100%
17.氯酸钾和亚硫酸氢钾能发生氧化还原反应:
 ClO3-+HSO3-→SO42-+Cl-+H+(未配平)。
ClO3-+HSO3-→SO42-+Cl-+H+(未配平)。
已知该反应的速率随c(H+)的增大而加快.下列为用ClO3-在单位时间内物质的量浓度变化表示的该反应V-t图。下列说法中不正确的是
A.反应开始时速率增大可能是c(H+)所致
B.纵座标为V(H+)的V-t曲线与图中曲线完全重合
C.后期反应速率下降的主要原因是反应物浓度减小
D.图中阴影部分“面积”可以表示t1-t2时间为n(Cl-)增加
16.25℃时,由水电离出的H+浓度是1×10-12mol·L-1的溶液中,pH等于
A.7 B. 2 C.12 D.14
15.对达到平衡状态的可逆反应:X+Y  W+Z,在t℃时增大压强,则正逆反应速率变化如图所示(V代表速率,t代表时间)下列有关X、Y、Z、W的状态叙述正确的是:
W+Z,在t℃时增大压强,则正逆反应速率变化如图所示(V代表速率,t代表时间)下列有关X、Y、Z、W的状态叙述正确的是:
|
 B.X、Y为气体,W、Z中有一种是气体
B.X、Y为气体,W、Z中有一种是气体
C.W、Z为气体,X、Y中有一种是气体
D.W、Z中有一种为气体,X、Y都不是气体
14.一定条件下,2CO(g) + O2(g) = 2CO2(g);△H= -566KJ/mol;
CH4(g) + 2O2(g) = CO2(g) + 2H2O(l); △H= - 890KJ/mol,则1molCO和3molCH4组成的混和气在上述条件下完全燃烧放出热量为 :
A.2912KJ B.2953KJ C.3236KJ D.3836KJ
13.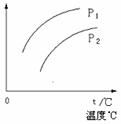 在容积一定的密闭容器中发生可逆反应A(g)+2B(g)
在容积一定的密闭容器中发生可逆反应A(g)+2B(g) 2C(g);△H>0,平衡移动关系如图所示。下列说法正确的是:
2C(g);△H>0,平衡移动关系如图所示。下列说法正确的是:
A.P1>P2,纵坐标指A的质量分数
B.P1> P2,纵坐标指C的质量分数
C.P1< P2,纵坐标指A的转化率
D.P1< P2,纵坐标指混合气体的平均摩尔质量
12.近年来,加“碘”食盐较多的使用了碘酸钾(KIO3),碘酸钾在工业上可用电解法制取。
以石墨和不锈钢为电极,以KI溶液为电解液,在一定条件下电解,反应方程式为:
KI+3H2O
 KIO3+3H2↑。下列有关说法不正确的是:
KIO3+3H2↑。下列有关说法不正确的是:
A.电解时,石墨作阴极,不锈钢作阳极 相对原子质量:K:39,I:127,O:16
B.电解时,阳极反应是:I――6e-+3H2O=IO3-+6H+
C.当电解过程中转移3mole-时,理论上可制得KIO3 107g
D.电解前后溶液的pH几乎不变
11. 氢镍电池是近年开发出来的可充电电池,它可以取代会产生镉污染的镉镍电池。氢镍电池的总反应式是H2+2NiO(OH) 2 Ni(OH)2。根据此反应式判断,下列叙述中正确的是:
氢镍电池是近年开发出来的可充电电池,它可以取代会产生镉污染的镉镍电池。氢镍电池的总反应式是H2+2NiO(OH) 2 Ni(OH)2。根据此反应式判断,下列叙述中正确的是:
A.电池放电时,电池负极周围溶液的PH不断增大 B.电池放电时,镍元素被氧化
C.电池充电时,氢元素被还原 D.电池放电时,H2充到正极
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com