
题目列表(包括答案和解析)
30.(8分)某研究性学习小组为证明在同温同压
下,相同浓度相同体积的不同强度的一元酸与足
量镁带反应时,生成氢气的体积相同而反应速率
 不同,同时测定实验室条件下的气体摩尔体积。
不同,同时测定实验室条件下的气体摩尔体积。
设计的简易实验装置如右图。该实验的主要操作
|
|
|
①配制浓度均为1 mol·L-1盐酸和醋酸溶液;
②用 量取10.00 mL1 mol·L-1盐酸和醋酸溶液分别加入两个锥形瓶中;
③分别称取除去表面氧化膜的镁带a g,并系于铜丝末端,a的数值至少为 ;
|
⑤将铜丝向下移动,使足量镁带浸入酸中(铜丝不与酸接触),至反应完全,记录 ;
⑥反应结束后待温度恢复到室温,若丙中液面高于乙中液面,读取量筒中水的体积前,
应 ,读出量筒中水的体积为V mL。
请将上述步骤补充完整并回答下列问题:
⑴用文字表述④检查该装置气密性的操作与观察方法:
。
⑵本实验中应选用 (填序号)的量筒。
A.100 mL B.200 mL C.500 mL
⑶简述速率不等的原因 ,铜丝不与酸接触的原因是 。
29.(10分)在25℃时,用石墨电极电解 ,
, 溶液。5min后,在一个石墨电极上有6.4g
Cu生成。试回答下列问题:
溶液。5min后,在一个石墨电极上有6.4g
Cu生成。试回答下列问题:
(1) 极发生氧化反应,电极反应式为 。
(2) 极发生还原反应,电极反应式为 。
(3)有 mol电子发生转移,得到 的体积(标准状况)是 L ,溶液的
的体积(标准状况)是 L ,溶液的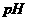 是 。反应速率v(Cu2+):v(O2)==
是 。反应速率v(Cu2+):v(O2)==
(4)如用等质量的两块铜片代替石墨作电极,电解后两铜片的质量相差
g ,电解液的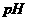 (填“变小”、“变大”或“不变”) (相对原子质量 Cu:64)
(填“变小”、“变大”或“不变”) (相对原子质量 Cu:64)
28.(4分)盖斯定律在生产和科学研究中有很重要的意义。有些反应的反应热虽然无法直接测得,但可通过间接的方法测定。现根据下列2个热化学反应方程式:
FeO(s)+CO(g)= Fe(s)+ CO2(g) △H= ―218kJ/mol
Fe3O4(s)+CO(g)==3FeO(s)+CO2(g) △H= +640.5kJ/mol
写出CO气体还原Fe3O4固体得到Fe固体和CO2气体的热化学反应方程式:
_________________
27.(4分)为更好地表示溶液的酸碱性,科学家提出了酸度(AG)的概念,AG=lg 。
。
(1)中性溶液的AG= (2)常温下0.01 mol·L-1盐酸溶液的AG=
26.(6分)日常生活中,可用明矾[KAl(SO4)2·12H2O]作为净水剂,这是因为:
(1)明矾溶于水发生水解反应,生成氢氧化铝胶体。该反应的离子方程式为:
。
(2)带 电的氢氧化铝胶体与水中带电性相反的土壤胶体发生 而使水净化。
25. 500℃、20 MPa时,将H2和N2置于一容
500℃、20 MPa时,将H2和N2置于一容
积为2 L的密闭容器中发生反应。反应过程
中H2、N2和NH3物质的量变化如图所示,
下列说法正确的是:
A.反应开始到第一次平衡时,N2的平均反
应速率为0.005mol·L-1·min-1
B.从曲线变化可以看出,反应进行到10 min
至20 min钟时可能是使用了催化剂
C.从曲线变化可以看出,反应进行至25min
钟时,分离出0.1mol的氨气
D.在25min钟时平衡正向移动但达到新平衡
后NH3的体积分数比原平衡小
|
第II卷 非选择题(共80分)
24. TiO2在光照射下可使水分解:2H2O 2H2↑+O2↑,
TiO2在光照射下可使水分解:2H2O 2H2↑+O2↑,
 该过程类似植物的光合作用。右图是光照射下TiO2分解水的
该过程类似植物的光合作用。右图是光照射下TiO2分解水的
装置示意图。下列叙述正确的是:
A.该装置可以将光能转化为电能,同时也能转化为化学能
B.铂电极上发生的反应为:2H++2e-=H2↑
C.该装置工作时,电流由TiO2电极经R流向铂电极
D.该装置工作时,TiO2电极附近溶液的pH变大
23.有甲、乙两醋酸稀溶液,测得甲的pH=2,乙的pH=3。下列推断中正确的是
A.物质的量浓度c(甲)=10c(乙)
B.甲中由水电离产生的H+的物质的量浓度是乙的0.1倍
C.中和等物质的量浓度等体积的NaOH溶液需甲、乙两酸的体积V(乙)=10V(甲)
D.甲中的c(OH-)为乙中c(OH-)的1/10倍
22.已知某溶液中只存在OH-、H+、CH3COO-、Na+四种离子,且其离子浓度的大小顺序为:c(Na+)>c(OH-)>c(CH3COO-)>c(H+),则原溶质可能为
A、CH3COONa B、CH3COONa、NaOH C、CH3COOH、CH3COONa D、CH3COOH、NaOH
21.下列反应的离子方程式正确的有
A.碳酸氢钙溶液中加入足量的苛性钠溶液:Ca2++HCO3-+OH-=CaCO3↓+H2O
B.二氧化碳通入碳酸钠溶液中:CO2+CO32-+H2O=2HCO3-
C.氯气通入冷的氢氧化钠溶液中:2Cl2+2OH-=3Cl-+ClO-+H2O
D.FeBr2溶液中通入足量的Cl2:2Fe2++Cl2=2Fe3++2Cl-
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com