
题目列表(包括答案和解析)
13.现有100mL 20%的硫酸溶液,其密度为1.14g/cm3.下列说法正确的是 ( )
A.该溶液含溶质20g B.该溶液中,溶质质量;溶液质量=1∶4
C.该溶液中,溶质质量∶溶剂质量=1∶5 D.该溶液中,溶液质量∶溶剂质量=5:∶4
答案:D
本题用到三个公式:溶液的质量=溶液的体积×密度,溶液质量∶溶质质量+溶剂质量,溶质的质量分数= ×100%.计算出溶液质量为100 mL×1.14 g/cm3=114 g,溶质质量为114 g×20%=22.8 g,溶剂质量为114 g-22.8 g=91.2 g,溶液质量;溶剂质量=5∶4.
×100%.计算出溶液质量为100 mL×1.14 g/cm3=114 g,溶质质量为114 g×20%=22.8 g,溶剂质量为114 g-22.8 g=91.2 g,溶液质量;溶剂质量=5∶4.
(1)如果错选A,原因是没有理解溶质的质量分数概念,计算式为100mL×20%=20g,体积和质量分数的乘积没有化学意义.化学计算不能等同于纯数学计算,一定要有化学意义.再如本题计算溶质的质量时可以灵活运用公式,一步计算;100mL×1.14 g/cm3×20%=22.8 g,100 mL×20%×11.4s/cm3=22.8g,两个式子计算的结果相等,但第二个式子没有化学意义,是错误的.
(2)从不同角度深刻理解概念,可以简化问题.溶质质量分数是溶质质量和溶液质量之比(百分比),20%的涵义是:每100份质量的溶液中含20份质量的溶质(那么溶剂为80份质量),该溶液中溶剂的质量和溶液的质量之比为80;100=4∶5,问题迎刃而解.
12.向40g 5%的NaOH溶液中,加入60g10%的NaOH溶液,混合后的溶液中NaOH的质量分数为______________;上述混合溶液,恰好能跟______________g10%的稀硫酸完全反应.
答案:8% 98
能力提高
11.如图9-9是甲、乙、丙三种物质(均不含结晶水)的溶解度曲线.现有t2℃时甲、乙、丙三种物质的饱和溶液(无固体存在),请根据图9-10回答:
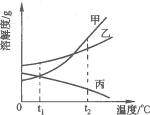
图9-9
(1)t2℃时,将三种饱和溶液分别恒温蒸发相同质量的水;析出晶体最多的是___________________;
(2)将三种饱和溶液分别从t2℃降温到t1℃时,所得溶液中溶质的质量分数从大到小的顺序为________________________.
答案:(1)甲 (2)乙、甲、丙
10.将mg KNO3的不饱和溶液恒温蒸发水分,直到有晶体析出.下列可表示在此变化过程中,溶液中溶质质量分数与蒸发时间的变化关系的是 ( )
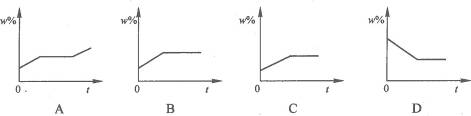
答案:C
9.配制90g质量分数为10%的硝酸钠溶液后,再向其中加入10g硫酸钾并搅拌至完全溶解,则所得溶液中硝酸钠的质量分数是 ( )
A.19% B.10% C.9% D.无法计算
答案:C
8.向饱和氯化钠溶液中加入一定量的氯化钠固体,保持温度不变,溶液中 ( )
A.溶液质量增加 B.溶质质量增加 C.溶质质量分数增大 D.溶质质量分数不变
答案:D
7.有5种溶液,根据已知量计算未知量,填入表9-6.
表9-6
|
溶质/g |
溶剂/g |
溶液/g |
溶液中溶质的质量分数 |
|
15 |
100 |
|
|
|
6 |
|
100 |
|
|
|
60 |
100 |
|
|
|
|
200 |
30% |
|
|
10 |
|
25% |
答案:115 13;94 6;40 40;60 140;3.3 13.3
基础巩固
6.配制溶质的质量分数为20%的硫酸溶液225g,需取60%(密度为1.5g/cms)的硫酸 ( )
A.45 mL B.50 mL C.35 mL D.67.5 mL
答案:B
5.下列操作不会改变溶液的质量分数的有 ( )
A.对不饱和溶液蒸发溶剂 B.对硝酸钾溶液降温有晶体析出
C.对饱和硝酸钾溶液降温 D.对某固体物质的饱和溶液恒温蒸发溶剂
答案:D
4.在一定温度下,某物质A的溶解度为mg,此温度时它的饱和溶液中溶质的质量分数为P%;则m和P的关系 ( )
A.P>m B.P<m C.P=m D.无法判断
答案:B
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com