
题目列表(包括答案和解析)
2、通常情况下,既能用浓硫酸干燥,又能用碱石灰干燥的是 ( )
A、NH3 B、Cl2 C、NO D、HCl
1、下列气体中,不会造成空气污染的是 ( )
A、N2 B、NO C、NO2 D、CO
23.(6分)白磷(P4)是正四面体构型的分子,当与氧气作用形成P4O10时,每两个磷原子之间插入一个氧原子,此外,每个磷原子又以双键结合一个氧原子。如下图:
化学反应可视为旧键断裂和新键形成的过程。现提供以下化学键的键能(kJ·mol-1)。
P-P键:198 kJ·mol-1; P-O键:360 kJ·mol-1; O=O键498 kJ· mol-1;
P=O键585 kJ· mol-1。
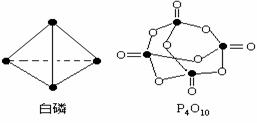
(1)试根据这些数据,计算出以下反应的反应热△H的值:P4(白磷)+5O2=P4O10
(2)P4O10极易与水化合,反应过程可表示为如下形式:P-O-P+H2O→2P-OH。若每个P4O10分子与四个水分子发生化合反应,写出该反应的化学方程式。

22.(6分)2003年10月16日“神舟五号”飞船成功发射,实现了中华民族的飞天梦想。
运送飞船的火箭燃料除液态双氧水外,还有另一种液态氮氢化合物。已知该化合物中氢元素的质量分数为12.5%,相对分子质量为32,结构分析发现该分子结构中只有单键。
(1)该氮氢化合物的结构式为 。
(2)若该物质与液态双氧水恰好完全反应,产生两种无毒又不污染环境的气态物质,写出该反应的化学方程式 。
(3)NH3分子中的N原子有一对孤对电子,能发生反应:NH3+HCl=NH4Cl。试写出上述
氮氢化合物通入足量盐酸时,发生反应的化学方程式 。
21.(10分)某离子晶体晶胞结构如下图所示,x位于立方体的顶点,Y位于立方体中心。试分析:
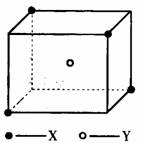 (1)晶体中每个Y同时吸引着__________个X,每个x同时
(1)晶体中每个Y同时吸引着__________个X,每个x同时
吸引着__________个Y,该晶体的化学式为__________ 。
(2)晶体中在每个X周围与它最接近且距离相等的X共有
__________个。
(3)晶体中距离最近的2个X与1个Y形成的夹角∠XYX的
度数为__________。
20.(4分)1949年度诺贝尔化学奖授予为研究臭氧做出特殊贡献的化学家。O3能吸收有害紫外线,保护人类赖以生存的空间。O3分子的结构如下图所示:呈V型,键角116.5° 。三个O原子以一个O原子为中心,与另外两个O原子分别构成一个非极性共价键;中间O原子提供2个电子,旁边两个O原子各提供1个电子,构成一个特殊的化学键(虚线内部分)- 三个O原子均等地享有这4个电子。请回答:
(1)题中非极性共价键是 键,特殊的化学键是 键。(填“σ”或“π”)
 (2)下列物质的分子与O3分子的结构最相似的是 。
(2)下列物质的分子与O3分子的结构最相似的是 。
A.H2O B.CO2 C.SO2 D.BeCl2
(3)原子中没有跟其他原子共用的电子对叫孤对电子,那么O3分子有 对孤对电子。
19.(21分)A、B、C、D是四种短周期元素,E是过渡元素。A、B、C同周期,C、D同主族,A的原子结构示意图为:,B是同周期第一电离能最小的元素,C的最外层有三个成单电子,E的外围电子排布式为3d64s2。回答下列问题:
(1)写出下列元素的符号:A _________ B__________ C __________ D __________
(2)用化学式表示上述五种元素中最高价氧化物对应水化物酸性最强的是__________,碱性最强的是_________。
(3)用元素符号表示D所在周期(除稀有气体元素外)第一电离能最大的元素是__________,电负性最大的元素是__________。
(4)D的氢化物比C的氢化物的沸点__________(填"高"或"低"),原因_____________
(5)E元素原子的核电荷数是__________,E元素在周期表的第_______周期,第________族,已知元素周期表可按电子排布分为s区、p区等,则E元素在_______区。
(6)A、B、C最高价氧化物的晶体类型是分别是______晶体、______晶体、______晶体
(7)画出D的核外电子排布图___________________________________________,这样排布遵循了____________原理和____________规则。
(8)用电子式表示B的硫化物的形成过程:______________________________________
18.(12分)Pt(NH3)2Cl2可以形成两种固体,一种为淡黄色,在水中的溶解度小,另一种为黄绿色,在水中的溶解度较大,请回答下列问题:
(1)Pt(NH3)2 Cl2是平面正方形结构,还是四面体结构
(2)请在以下空格内画出这两种固体分子的几何构型图,
淡黄色固体: , 黄绿色固体:
(3)淡黄色固体物质是由 分子组成,黄绿色固体物质是由
分子组成(填“极性分子”或“非极性分子”)
(4)黄绿色固体在水中溶解度比淡黄色固体大,原因是 。
17.(5分)在HF、H2O、NH3、CH4、N2、CO2、HI分子中:
(1)以非极性键结合的非极性分子是 。
(2)以极性键相结合,具有正四面体结构的非极性分子是 。
(3)以极性键相结合,具有三角锥型结构的极性分子是 。
(4)以极性键相结合,具有折线型结构的极性分子是 。
(5)以极性键相结合,而且分子极性最大的是 。
16.下列说法中正确的是
A.NO2、SO2、BF3分子中所有原子的最外层电子都满足了8e-稳定结构 B.P4和CH4都是正四面体分子且键角都为109o28ˊ C.NaCl晶体中与每个Na+距离相等且最近的Na+共有12个 D.原子间通过共价键而形成的晶体一定具有高的熔、沸点及硬度
第Ⅱ卷(非选择题 共64分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com